- Etanoato de etilo
-
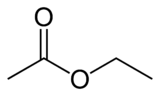
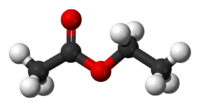
Acetato de Etilo
Nombre (IUPAC) sistemático Acetato de etilo General Otros nombres Acetato de etilo; acetidina Fórmula semidesarrollada CH3COOCH2-CH3 Fórmula molecular C4H8O2 Identificadores Número CAS 141-78-6 Número RTECS AH5425000 Propiedades físicas Estado de agregación Líquido incoloro, de olor característico. Densidad 900 kg/m3; 0,9 g/cm3 Masa molar 88,11 g/mol Punto de fusión 189 K (-83 °C) Punto de ebullición 350 K (77 °C) Viscosidad 0,45 cP a 20 °C Índice de refracción 1,3724 a 20 °C Propiedades químicas Solubilidad en agua 8,7% a 20 °C Momento dipolar 1,88 a 25 °C D Compuestos relacionados ácido acético, etanol Peligrosidad Punto de inflamabilidad 280 K (7 °C) NFPA 704 Temperatura de autoignición 700 K (427 °C) Número RTECS AH5425000 Riesgos Altamente inflamable. Ingestión Dolor abdominal, vértigo, náusea, dolor de garganta, debilidad. Inhalación Tos, vértigo, somnolencia, dolor de cabeza, náusea, jadeo, dolor de garganta, pérdida de conocimiento, debilidad. Piel Enrojecimiento, dolor. LD50 11,3 g/kg, rat Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl etanoato de etilo, también llamado acetato de etilo según la IUPAC, y de otras formas (ver tabla) es un éster de fórmula CH3-COO-CH2-CH3. Su nombre antiguo es éter de vinagre, en alemán Essig-Äther, de donde proviene el término "esther" o éster .
El acetato de etilo es un líquido incoloro, característico de los ésteres, no residual. Es miscible con hidrocarburos, cetonas, alcoholes y éteres y poco soluble en agua. Se emplea en arte como disolvente universal.
Contenido
Síntesis
La principal forma de sintetizar acetato de etilo es mediante la esterificación de Fischer, esterificación directa mediante ácido acético y etanol en presencia de un catalizador.
- CH3CH2OH + CH3COOH ⇌ CH3COOCH2CH3 + H2O
Otro método de preparar ésteres es emplear no el ácido en sí, sino su cloruro, el etanoato de etilo se puede obtener por la acción del alcohol sobre el cloruro del ácido etanoico. Otro método de obtención, aunque no económicamente viable, consiste en hacer reaccionar las sales de plata de los ácidos con halogenuro de alquilo, el etanoato de etilo se puede preparar en presencia de etanoato de plata y yoduro de etilo. Es insoluble en agua y se disuelve con facilidad en disolventes orgánicos. Reacciona con el agua para formar ácido acético y etanol, una reacción que es catalizada por la presencia de ácidos.
Aplicaciones
Industria química
- Producción de tintas de impresión para la industria gráfica.
- Producción de thinners y solventes de pinturas en industria de pinturas.
- En la industria de adhesivos y colas derivados de la celulosa.
- En la industria alimenticia, en productos de confitería, bebidas, dulces.
- En esencias artificiales de frutas.
- Remoción de sustancias resinosas en la industria del caucho.
- En la elaboración de cueros artificiales y para revestir y decorar artículos de cuero.
- Disolvente de compuestos utilizados para revestir y decorar objetos de cerámica.
- Solvente para la elaboración de varios compuestos explosivos.
- En la industria fotográfica, como solvente para la fabricación de películas a base de celulosa.
- Ingrediente de preparaciones cosméticas (perfumes, esmaltes, tónicos capilares) y farmacéutica.
- En la industria del papel, para la elaboración de papeles aprestados y para recubrir y decorar objetos de papel.
- En la industria textil, para la preparación de tejidos de lana para teñido, en procesos de limpieza y para la elaboración de textiles aprestados.
- Reactivo para la manufactura de pigmentos.
El uso directo en el procesado de medicamentos y de alimentos no se recomienda.
Aplicaciones en el laboratorio
En el laboratorio, el acetato de etilo es comúnmente usado en mezclas para cromatografía líquida y extracción. Es raramente seleccionado como un disolvente de reacción porque es propenso a la hidrólisis y a la transesterificación. El acetato de etilo es muy volatil y tiene un bajo punto de ebullición. Debido a estas propiedades, puede recuperarse de una muestra por calentamiento de la misma en un baño de agua y ventilando con aire comprimido.
Presencia en el vino
El acetato de etilo es uno de los componentes del vino, forma parte de la serie disolvente, también conocida como etérea, junto con alcoholes de menos peso y algunos ésteres más pesados. Se produce principalmente en una crianza de tipo oxidativo, y por tanto se encuentra en una mayor proporción en los vinos olorosos.
Síntesis química
Es un prometedor disolvente para la síntesis comercial de la vitamina E. Además, el acetato de etilo posee una muy buena capacidad de solvatación con respecto al reactivo y permite reducir la temperatura de proceso a 80 °C, que ciertamente incrementaría la calidad del producto (vitamina E). Sin embargo, hay algunos problemas relativos a la regeneración del acetato de etilo, en comparación con los anteriores disolventes utilizados en este proceso (acetato de butilo), ya que es más soluble en agua, más volátil, y está más sujeto a hidrólisis bajo las condiciones de síntesis.
Seguridad
Producto inflamable, no almacenar o mezclar con oxidantes fuertes, tales como cloro líquido y oxígeno concentrado. No manipular o almacenar cerca de llamas abiertas, calor, chispas, requiere ventilación adecuada. Es irritante de piel y vías respiratorias. Para conocer más información consultar la ficha internacional de seguridad química.
Referencias
- É. Yu. Bulychev, Yu. A. Pisarenko, and D. L. Efremov (2001). «Solvent regeneration in the synthesis of Vitamin E». Pharmaceutical Chemistry Journal 35 (9). p. 51-52. http://www.springerlink.com/content/tdbt934yn93akeqb/fulltext.pdf?page=1.
- Breda, Evangelina (2008). Esterificación de Fischer. http://www.scribd.com/doc/22038381/Tp-3-Sintesis-de-Acetato-de-Etilo.
Enlaces externos
- [1]Ficha internacional de seguridad química. Consultado el 9 de marzo de 2010.
- [2]Propiedades del acetato de etilo. Consultado el 9 de marzo de 2010.
- [3]Ficha técnica del acetato de etilo. Consultado el 24 de marzo de 2010.
- [4]Federación Española de Asociaciones de Enólogos. Consultado el 18 de marzo de 2010.
- [5]Atanor. Consultado el 11 de marzo de 2010.
Categoría:- Ésteres
Wikimedia foundation. 2010.