- Dicromato de amonio
-
Dicromato de amonio
Dicromato de amonioNombre (IUPAC) sistemático Dicromato de amonio General Fórmula semidesarrollada (NH4)2Cr2O7 Fórmula molecular n/d Identificadores Número CAS [7789-09-5 [7789-09-5]] Propiedades físicas Estado de agregación Sólido Apariencia Anaranjado intenso Densidad 2.150 kg/m3; 2.15 g/cm3 Masa molar 252.07 g/mol Punto de fusión 453 K (179,85 °C) Punto de ebullición Se descompone a 453 K (Expresión errónea: palabra "se" desconocida °C) Propiedades químicas Solubilidad en agua 364 g/l a 20 °C en agua Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl dicromato de amonio es una sal del hipotético ácido dicrómico (este ácido en sustancia no es estable). Se trata de una sustancia con un color anaranjado intenso. Es un oxidante fuerte y en contacto con sustancias orgánicas puede provocar incendio o explosión.
Es fundamentalmente conocido por su uso en la demostración de la descomposición térmica de una sustancia, ya que al ser calentada o encendida por una llama, se produce la reacción:
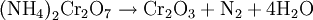
La reacción se produce debido al poder oxidante del ión dicromato y al reductor del ión amonio. Otro ejemplo es la reacción de descomposición explosiva del nitrato de amonio. Actualmente esta experiencia se realiza cada vez menos debido a la toxicidad de uno de los productos: el óxido de cromo III.
Aplicaciones
El dicromato de amonio era antiguamente usado en pirotecnia y en fotografía, y actualmente se la utiliza como mordiente en la industria textil para purificar grasas o aceites y como oxidante en síntesis orgánica.
Toxicología
El dicromato de amonio es tóxico. En contacto con la piel se produce sensibilización y puede provocar alergias. Al igual que los cromatos, los dicromatos son cancerígenos. En el cuerpo son confundidos por los canales iónicos con el sulfato y pueden llegar así hasta el núcleo de la célula. Allí son reducidos por la materia orgánica presente y el cromo III formado, ataca a la molécula de ADN.
Categorías: Cromatos | Compuestos de amonio
Wikimedia foundation. 2010.

