- Difosgeno
-
Difosgeno
 Difosgeno
DifosgenoNombre (IUPAC) sistemático triclorometil cloroformato General Fórmula molecular n/d Identificadores Número CAS 503-38-8 503-38-8 Número RTECS LQ7350000 Propiedades físicas Apariencia cristales incoloros Densidad Expresión errónea: carácter de puntuación "." desconocido kg/m3; 1,65 g/cm3 Masa molar 197,82 g/mol Punto de fusión K (-273,15 °C) Punto de ebullición 401 K (127,85 °C) Propiedades químicas Solubilidad en agua n/d Peligrosidad NFPA 704 Número RTECS LQ7350000 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
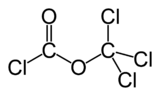
Exenciones y referenciasEl difosgeno es un compuesto químico de fórmula ClCO2CCl3. Este líquido incoloro es un importante reactivo en la síntesis de los compuestos orgánicos. El difosgeno está relacionado con el fosgeno, pero es más fácil de manipular gracias a su forma líquida habitual, mientras que el segundo se presenta en condiciones ambientales en forma de gas.
Contenido
Producción y usos
El difosgeno se produce mediante la creación de radicales libres de cloro en cloroformato de metilo mediante una lámpara ultravioleta[1]
El difosgeno se convierte en fosgeno al calentarse, o mediante catálisis usando carbón vegetal. Por ello, es útil en reacciones que empleen fosgeno. Por ejemplo, se usa para convertir aminas en isocianatos, aminas secundarias en cloruros carbonados, ácidos carboxílicos en cloruros acílicos y formamida en isocianida. El difosgeno sirve también como fuente para dos tipos de fosgeno:
- 2 RNH2 + ClCO2CCl3 → 2 RNCO + 4 HCl
Al mezclarse con α-aminoácidos el difosgeno genera isocianatos de cloruro, OCNCHRCOCl, o bien anhídridos de ácido N-carboxi-amino, dependiendo de las condiciones ambientales.
En un ambiente húmedo se hidroliza, liberando HCl.
El difosgeno ha sustituido al fosgeno en algunas reacciones industriales a gran escala, como la producción de (di-)isocianatos a partir de aminas, ya que es más seguro de manipular y almacenar que este.
Uso militar
El difosgeno fue desarrollado originalmente para su uso en guerra química, pocos meses después del fosgeno. Los alemanes lo usaron como gas venenoso en proyectiles de artillería durante la Primera Guerra Mundial. El primer uso registrado en combate fue en mayo de 1916. Los vapores de difosgeno podían destruir los filtros de carbono de las máscaras de gas usadas en esa fecha.
Seguridad
El difosgeno tiene una presión de vapor relativamente alta, de 10 mmHg (1.3 kPa) a 20 °C, y se descompone en fosgeno alrededor de los 300 °C. La exposición al difosgeno es similar en peligrosidad a la del fosgeno.
Referencias y notas
- ↑ TRICHLOROMETHYL CHLOROFORMATE AS A PHOSGENE EQUIVALENT: 3-ISOCYANATOPROPANOYL CHLORIDE (en inglés)
Véase también
Enlaces externos
- medical care guide en Inglés.
- NATO guide, includes treatment advice en Inglés.
- material safety data sheet (PDF, for phosgene and diphosgene treated as one). en Inglés.
Categoría: Compuestos químicos
Wikimedia foundation. 2010.

