- Diisopropilamida de litio
-
Diisopropilamida de litio
 Diisopropilamida de litio
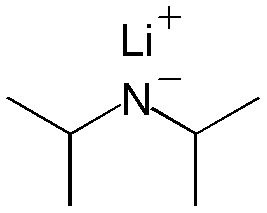
Diisopropilamida de litioNombre (IUPAC) sistemático Diisopropilamida de litio General Otros nombres LDA Fórmula semidesarrollada LiN(C3H7)2 Fórmula molecular n/d Identificadores Número CAS 4111-54-0 Propiedades físicas Densidad 790 kg/m3; 0,79 g/cm3 Masa molar 107,1233 g/mol Punto de fusión K (-273,15 °C) Punto de ebullición K (-273,15 °C) Propiedades químicas Acidez (pKa) 36 (THF)[1] Solubilidad en agua Reacciona con el agua Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa diisopropilamida de litio es el compuesto químico con la fórmula [(CH3)2CH]2NLi. Generalmente abreviada como LDA, es una base muy fuerte usada en química orgánica para la deprotonación de compuestos débilmente acídicos. El reactivo ha sido ampliamente aceptado, debido a que es soluble en solventes orgánicos no polares, y no es pirofórico. El LDA es una base no nucleofílica. La diisopropilamida de potasio (KDA) es un compuesto similar, pero en vez del catión litio tiene un catión potasio. El LDA es más barato que el KDA, y es más ampliamente usado, aunque el KDA es más efectivo.
Contenido
Preparación y estructura
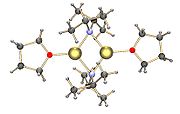
El LDA se forma comúnmente tratando una solución de diisopropilamina en tetrahidrofurano (THF) enfriada (0 a −78 °C) con pKa de 36; en consecuencia es apto para la deprotonación de los ácidos de carbono más comunes, incluyendo alcoholes y compuestos carbonílicos (ácidos, ésteres, aldehídos y cetona) que posee un carbono α con hidrógeno. En solución de THF, el LDA existe principalmente como un dímero[3] [4] y se cree que se disocia para producir la base activa.
El LDA está disponible comercialmente como una solución con solventes polares, apróticos, tales como el THF y el éter, aunque en la práctica, y para uso a pequeña escala (menos de 50 mmol) es común y más efectivo preparar el LDA in situ.
Bases cinéticas vs termodinámicas
Kinetic vs thermodynamic bases
La deprotonación de los ácidos de carbono puede proceder tanto por control termodinámico o control cinético. La deprotonación controlada cinéticamente requiere una base que esté impedida estéricamente. Por ejemplo, en el caso de la fenilacetona, la deprotonación puede producir dos enolatos diferentes. El LDA ha mostrado deprotonar el grupo metilo, que es el curso cinético de la deprotonación. Una base más débil, como un alcóxido, que deprotona reversiblemente al sustrato, conduce al enolato bencílico termodinámicamente más estable. Una alternativa a la base débil es el uso de una base fuerte que esté presente a una concentración menor que la cetona. Por ejemplo, con hidruro de sodio en THF o dimetilformamida (DMF), la base sólo reacciona en la interface solución-sólido. Una molécula de cetona podría ser deprotonada en el sitio cinético. Este enolato puede entonces encontrarse con otra molécula de cetona y se formará el enolato termodinámico por intercambio de protones, incluso en un solvente aprótico que no contiene iones oxonio.
Sin embargo, el LDA actúa como un nucleófilo bajo ciertas condiciones. Por ejemplo, puede reaccionar con hexacarboniltungsteno como parte de la síntesis de un diisopropilaminocarbino.[cita requerida] Si se dan las condiciones apropiadas, el LDA actuará como cualquier otro nucleófilo y llevará a cabo reacciones de condensación. Se conocen otras amidas más impedidas, por ejemplo, la deprotonación del hexametildisilazano (Me3SiNHSiMe3) forma tales bases ([(Me3SiNSiMe3]-).
Referencias
- ↑ David Evans Research Group
- ↑ Smith, A. P.; Lamba, J. J. S.; Fraser, C. L. (2004). "Efficient Synthesis of Halomethyl-2,2'-Bipyridines: 4,4'-Bis(chloromethyl)-2,2'-Bipyridine". Org. Synth.; Coll. Vol. 10: 107.
- ↑ Williard, P. G.; Salvino, J. M. (1993). «Synthesis, isolation, and structure of an LDA-THF complex» Journal of Organic Chemistry. Vol. 58. n.º 1. pp. 1–3. DOI 10.1021/jo00053a001.
- ↑ N.D.R. Barnett, R.E. Mulvey, W. Clegg and P.A. O'Neil (1991). «Crystal structure of lithium diisopropylamide (LDA): an infinite helical arrangement composed of near-linear nitrogen-lithium-nitrogen units with four units per turn of helix» Journal of the American Chemical Society. Vol. 113. n.º 21. pp. 8187. DOI 10.1021/ja00021a066.
Enlaces externos
Categorías: Bases | Compuestos de litio
Wikimedia foundation. 2010.