- Diyodo
-
Diyodo
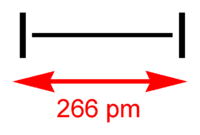
Nombre (IUPAC) sistemático Diyodo General Otros nombres Iodo diatómico; Yodo; Iodo. Fórmula semidesarrollada I2 Fórmula molecular n/d Identificadores Número CAS n/d Propiedades físicas Estado de agregación Sólido Apariencia Negro lustroso con brillo metálica Densidad 4940 kg/m3; 4,94 g/cm3 Masa molar 253,80894 g/mol Punto de fusión 386,85 K (113,70 °C) Punto de ebullición 457,4 K (184,3 °C) Propiedades químicas Solubilidad en agua 0,029 g/100 mL (20 °C) Termoquímica Calor específico 145 cal/g Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl yodo molecular o diyodo[1] (generalmente llamado sólo yodo o iodo) es una molécula diatómica homonuclear compuesta por dos átomos de yodo (I2). En condiciones normales es un sólido negro y lustroso con ligero brillo metálico, pero volatiliza fácilmente dando un gas de color violeta y olor irritante.
Contenido
Características principales
Al igual que el resto de halógenos forma un gran número de compuestos con otros elementos, pero es el menos reactivo del grupo y tiene ciertas características metálicas.
Es poco soluble en agua, mientras que se disuelve fácilmente en CHCl3, CCl4, o en CS2, dando disoluciones de color violeta. En disolución, en presencia de almidón forma un complejo de coloración azulada (muchas veces referido erróneamente como ioduro de almidón).
El I2 en una disolución de yoduros (I-), forma poliyoduros, y a causa de esto aumenta su solubilidad en este medio. Los poliyoduros que forma pueden ser el triyoduro, I3-, o el pentayoduro, I5-. También forma compuestos con otros haluros, por ejemplo el IF8-
Aplicaciones
- Como tintura de iodo, lugol o povidona iodo se emplea como desinfectante aplicándolo en las heridas.
- Para tratar enfermedades relacionadas con la tiroides.
- El yodo en solución se utiliza mucho en las técnicas de laboratorio.
Historia
El yodo (del griego iodes, que significa "violeta") fue descubierto en Francia por el químico francés Barnard Courtois en 1811 a partir de algas marinas, aunque no continuó con sus investigaciones por falta de dinero. Posteriormente, el químico inglés Humphry Davy y el químico francés Gay-Lussac estudiaron por separado esta sustancia y terminaron identificándola definitivamente como un nuevo elemento. Ambos dieron el crédito del descubrimiento a Courtois.
Abundancia y obtención
El yodo es el halógeno menos abundante, presentándose en la corteza terrestre con una concentración de 0,14 ppm, mientras que en el agua de mar su abundancia es de 0,052 ppm.
El yodo se obtiene a partir de los yoduros, I-, presentes en el agua de mar y en algas, o en forma de yodatos, IO3- a partir de los nitratos de Chile (separándolos previamente de éstos).
- En el caso de partir de yodatos, una parte de éstos se reducen a yoduros, y los yoduros obtenidos se hacen reaccionar con el resto de yodatos, obteniédose yodo:
- IO3- + 5I- + 6H+ → 3I2 + 3H2O
- Cuando se parte de yoduros, estos se oxidan con cloro y el yodo obtenido se separa mediante filtración. Se puede purificar reduciéndolo y reoxidándolo con cloro.
El yodo molecular puede prepararse de forma ultrapura haciendo reaccionar KI con CuSO4.
Precauciones
- Es necesario tener cuidado cuando se maneja yodo pues el contacto directo con la piel puede causar lesiones.
- Algunas personas pueden ser alérgicas al iodo molecular (como haptenos).
- El vapor de yodo es muy irritante para los ojos y las mucosas.
Véase también
Referencias
- ↑ Connelly, Neil G. (2005). «Nomenclature of inorganic chemistry - IUPAC recommendations». Nomenclature of Inorganic Chemistry. p. 49, ISBN 0-85404-438-8. http://books.google.com/books?id=w1Kf1CakyZIC&pg=PA49&lpg=PA49&dq=IR-3.4.3+Names+of+allotropes+of+definite+molecular+formula&source=web&ots=rMxMYCRX0d&sig=Tf0aQ10Re2ZdhQo807qAJNFGycE.
Enlaces externos
- ATSDR en Español - ToxFAQs™: yodo
- EnvironmentalChemistry.com - Iodine
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del yodo.
- WebElements.com - Iodine
Wikimedia foundation. 2010.
