- Ecuación de Henderson-Hasselbalch
-
Ecuación de Henderson-Hasselbalch
La ecuación de Henderson-Hasselbalch (frecuentemente mal escrito como Henderson-Hasselbach) fórmula bioquímica que se utiliza para calcular el pH, de una solución buffer, o tampón, a partir del pKa (la constante de disociación del ácido) y de las concentraciones de equilibrio del ácido o base, del ácido o la base conjugada.
![pH = pK_a + \log \left ( \frac{[A^-]}{[AH]} \right )](/pictures/eswiki/98/bbe9ded25965b98c36100318b083c5c7.png)
![pOH = pK_b + \log \left ( \frac{[BH^+]}{[B]} \right )](/pictures/eswiki/48/0cffdb343e405746d997b632ee68e0eb.png)
![pH = pK_x + \log \left ( \frac{[S]}{[A]} \right )](/pictures/eswiki/99/c58ff240eb26c458e70d3651254baa46.png)
donde:
- S es la sal o especie básica, y
- A es el ácido o especie ácida
En la última ecuación x puede ser a o b indistintamente.
Contenido
Observaciones
La ecuación implica el uso de las concentraciones de equilibrio del ácido y su base conjugada. Para el cálculo del pH en soluciones buffer, generalmente se hace una simplificación y se utilizan las concentraciones iniciales del ácido y la sal, por lo tanto se debe tener en cuenta que el valor obtenido es una aproximación y que el error será mayor cuanto mayor sea la diferencia de las concentraciones de equilibrio con las de partida (constante de equilibrio alta). En la misma aproximación, tampoco se considera el aporte del agua, lo cual no es válido para soluciones muy diluidas.
Derivación
Supóngase un ácido AH con disociación parcial. El equilibrio es:
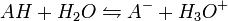
y la constante de disociación asociada será:
![K_{a} = \frac{[A^-][H_{3}O^+]}{[AH]}](/pictures/eswiki/53/5c4cf2bd8148e55177b236322b9bd7e3.png)
Despejando [H3O + ] de la constante de disociación:
![[H_{3}O^+] = \frac{K_{a}[AH]}{[A^-]}](/pictures/eswiki/52/445f67a1657acb974dea7fd139406700.png)
Tomando logaritmos a ambos lados y aplicando la propiedad de los logaritmos para un producto se llega a:
![- \log_{10} \left ( [H_{3}O^+] \right ) = - \log_{10} \left ( K_{a} \right ) - \log_{10} \left ( \frac{[AH]}{[A^-]} \right )](/pictures/eswiki/100/dbc1b42108dd6ae49d0aaef97aaa637b.png)
E invirtiendo el cociente:
![pH = pK_{a} + \log_{10} \left ( \frac{[A^-]}{[AH]} \right )](/pictures/eswiki/51/33901836dc6b8731ef86c4c40afc054b.png)
Aplicación Farmacológica
La fórmula de Henderson-Hasselbalch es empleada para medir el mecanismo de absorbción de los fármacos en la economía corpórea. Dicho de otra manera, la absorbción es la transferencia de un fármaco hacia un sitio de administración hacial el sangre. Los rangos de rapidéz y eficacia de la absorción farmacológica dependen de una ruta específica de administración, sea esta en su disposición farmacológica traslocarse al interior de la membrana celular para estimular el efecto organísmico deseado, por lo que la administración farmacéutica por diferentes rutas mucosas dependen de su biodisponibilidad farmacológica. Para ello se requiere que para la translocación del fármaco se necesite qu este desde su formulación farmacéutica no se disocie al llegar a la membrana celular, sea de caracter liposoluble, y de bajo peso molecular por lo que debe de ser de características de ácidos y bases débiles.
- El efecto del pH en la absorción farmacológica se media estudiando el pH de las presentaciones farmacéuticas:
- Fármacos Ácidos Débiles [HA]: Liberan un [H+] causando una carga aniónica [A-], para formar: [HA] <-> [H+] + [A-].
- Fármacos Alcalinos Débiles [BH+]: Liberan también un [H+]. La forma ionizada de los fármacos base son usualmente cargados, y pierden un protón que produce una base sin carga [B], para formar: [BH+] <-> [B] + [H+].
- Tomando el pH de ciertas mucosas, por ejem:
- Cavidad Oral: 5 a 6 pH.
- Mucosa Gástrica: 1 a 3 pH.
- Mucosa Intestinal: 4 a 5 pH.
- Y Tomando el pK de ciertos fármacos, por ejem:
- Morfina: (Base) 9 pK.
- Azetaminofen: (Ácido) 8 pK.
- Diazepam: (Ácido) 4 pK.
- Aspirina: (Ácido) 3 pK.
- Ejecutando la fórmula de Henderson-Hasselbalch para el ejemplo de:
- Aspirina administrada vía enteral, absorbida en la mucosa gástrica:
![pH = pK_a + \log \left ( \frac{[A^-]}{[AH]} \right )](/pictures/eswiki/98/bbe9ded25965b98c36100318b083c5c7.png)
Despeje:
3= 1+log [AH]/[A][H+]
3-1= log [AH]/[A][H+]
2= log [AH]/[A][H+]
antilog 2= [AH]/[A][H+]
100= [AH]/[A][H+]
100/1= [AH]/[A][H+]
101-100% 100-x% res x= 99% Quiere decir, que la administración enteral de la aspirina, alcanza una absorción casi al 100%, logrando una efctividad de translocación mayor.
Enlaces externos
Categorías: Ecuaciones | Química ácido-base | Tampones | Farmacocinética
Wikimedia foundation. 2010.
