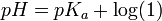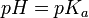- Valoración química
-
Valoración química
- En medicina, titulación o valoración es el proceso de ajuste gradual de la dosis de un medicamento hasta alcanzar el efecto deseado.
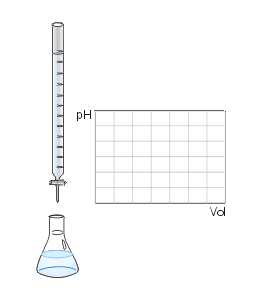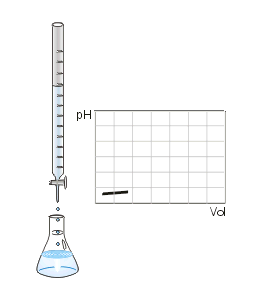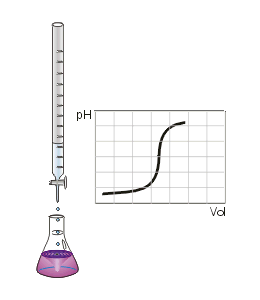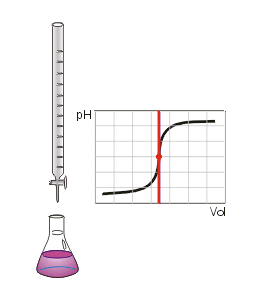 Titulación o valoración ácido-base: gotas de la disolución que sirve para titular o valorar caen desde la bureta sobre disolución de la sustancia a analizar en el vaso de precipitados. Un indicador presente cambia de color de modo permanente en el punto de equivalencia.
Titulación o valoración ácido-base: gotas de la disolución que sirve para titular o valorar caen desde la bureta sobre disolución de la sustancia a analizar en el vaso de precipitados. Un indicador presente cambia de color de modo permanente en el punto de equivalencia.La titulación o valoración es un método de laboratorio común en análisis químico cuantitativo usado para determinar la concentración de un sustrato o analito. Las medidas de volumen juegan un papel importante en la titulación o valoración, por eso se llama también análisis volumétrico.[1]
¿En qué consiste una valoración?
Un reactivo de concentración y volumen conocidos (una solución patrón o estándar) se usa para reaccionar con la sustancia a analizar, cuya concentración no es conocida de antemano. Se usa una bureta calibrada para añadir la disolución titulante, siendo así posible determinar la cantidad exacta que se ha consumido cuando se alcanza el punto final o punto de equivalencia. El punto final es el punto en el que la titulación o valoración está completa, y suele determinarse mediante un indicador (ver debajo). Este tiene idealmente el mismo volumen que el punto de equivalencia - el volumen de disolución estándar añadido para el cual el número de equivalentes de la sustancia tituladora es igual al número de equivalentes de la sustancia a analizar (analito). En una valoración ácido fuerte-base fuerte, el punto final de la titulación o valoración es el punto en el que el pH de la mezcla es justamente igual a 7, y a menudo coincide con un cambio de color de la disolución debido a un indicador de pH. Hay muchos tipos diferentes de titulaciones o valoraciones.
Pueden usarse muchos métodos para indicar el punto final de una reacción: a menudo se usan indicadores visuales (cambian de color). En una titulación o valoración ácido-base simple, puede usarse un indicador de pH, como la fenolftaleína, que es normalmente incolora pero adquiere color rosa cuando el pH es igual o mayor que 8,2. Otro ejemplo es el naranja de metilo, de color rojo con los ácidos y amarillo en disoluciones básicas.
No todas las titulaciones requieren un indicador. En algunos casos, o bien los reactivos o los productos tienen colores fuertes y pueden servir como "indicador". Por ejemplo, una titulación o valoración redox que usa permanganato de potasio como disolución estándar (rosa/violeta) no requiere indicador porque sufre un cambio de color fácil de detectar pues queda incolora al reducirse. Después del punto de equivalencia, hay exceso de la disolución titulante y persiste un color rosado débil que no pierde el color.
Debido a la naturaleza logarítmica de la curva de pH, las transiciones en el punto final son muy rápidas; y entonces, una simple gota puede cambiar el pH de modo muy significativo y provocar un cambio de color en el indicador. Hay una ligera diferencia entre el cambio de color del indicador y el punto de equivalencia de la titulación o valoración. Este error se llama error de indicador, y es indeterminado.
Historia y etimología
La palabra "titulación" viene del Latín titalus, que significa inscripción o título. La palabra francesa titre, del mismo origen, significa rango o grado. Una titulación o valoración es, por definición, la determinación del grado o concentración de una disolución.
Los orígenes del análisis volumétrico están en Francia en la química de finales del siglo XVII. François Antoine Henri Descroizilles desarrolló la primera bureta (con aspecto de un cilindro graduado) en 1791. Joseph Louis Gay-Lussac desarrolló una versión mejorada de la bureta que incluía un brazo lateral, y acuñó los términos "pipeta" y "bureta" en un artículo de 1824 sobre la estandarización de disoluciones de índigo. Un gran paso adelante en la metodología y popularización del análisis volumétrico se debe a Karl Friedrich Mohr, que rediseñó la bureta colocando un cierre con pinza y una cánula de vertido en el extremo inferior, y escribió el primer libro sobre su uso, Lehrbuch der chemisch-analytischen Titrirmethode (Manual sobre métodos de titulación en Química Analítica), publicado en 1855.[2]
Preparación de una muestra para titulación o valoración
En un titulación o valoración, la sustancia patrón y el analito deben estar en fase acuosa, en disolución. Si la muestra no es un líquido o una disolución, debe ser disuelta. Si el analito está muy concentrado en la muestra a analizar, suele diluirse.
Aunque la amplia mayoría de titulaciones se llevan a cabo en disolución acuosa, pueden usarse otros disolventes como ácido acético o etanol con igual finalidad.
Una cantidad medida de muestra se coloca en un frasco donde se disuelve y se diluye si es necesario. La cantidad de disolvente usado para disolver o diluir debe ser bien conocida (generalmente es un coeficiente entero) para poder considerarlo en el resultado matemático de la valoración de la muestra original.
Muchas valoraciones requieren un cierto control del pH de la reacción. Para ello, se usan disoluciones amortiguadoras añadidas a la disolución a analizar.
En otros casos se debe enmascarar un cierto ión: esto es necesario cuando hay dos reactivos en la muestra que pueden reaccionar con la sustancia patrón y solo queremos valorar uno de ellos, o bien cuando la reacción puede ser inhibida o alterada por la presencia de ese ión. Se procede añadiendo otra disolución a la muestra para enmascarar o secuestrar el ión no deseado, mediante la formación de un enlace débil con él o incluso formando una sustancia insoluble.
Algunas reacciones redox pueden requerir calentar la disolución con la muestra y valorar mientras está todavía caliente (para incrementar la velocidad de reacción).
Procedimiento
Una titulación o valoración comienza con un vaso de precipitados o matraz Erlenmeyer conteniendo un volumen preciso del reactivo a analizar y una pequeña cantidad de indicador, colocado debajo de una bureta que contiene la disolución estándar. Controlando cuidadosamente la cantidad añadida, es posible detectar el punto en el que el indicador cambia de color. Si el indicador ha sido elegido correctamente, este debería ser también el punto de neutralización de los dos reactivos. Leyendo en la escala de la bureta sabremos con precisión el volumen de disolución añadida.
Como la concentración de la disolución estándar y el volumen añadido son conocidos, podemos calcular el número de moles de esa sustancia (ya que concentración = moles / volumen). Luego, a partir de la ecuación química que representa el proceso que tiene lugar, podremos calcular el número de moles de la sustancia a analizar presentes en la muestra. Finalmente, dividiendo el número de moles de reactivo por su volumen, conoceremos la concentración buscada.
Curvas de valoración
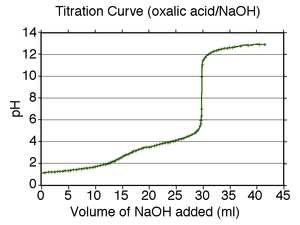 Una curva típica de valoración de un ácido diprótico, ácido oxálico, titulado con una base fuerte, hidróxido sódico. Son visibles los dos puntos de equivalencia, a 15 y 30 mL
Una curva típica de valoración de un ácido diprótico, ácido oxálico, titulado con una base fuerte, hidróxido sódico. Son visibles los dos puntos de equivalencia, a 15 y 30 mL
Las valoraciones se representan mediante curvas de valoración, en las que suele representarse como variable independiente el volumen añadido de disolución estándar, titulante o patrón, mientras la variable dependiente es el pH de la disolución (que cambia según la composición de las dos disoluciones). El punto de equivalencia es un punto significativo en la gráfica (el punto en el que toda la disolución inicial, usualmente un ácido, ha sido neutralizado por la disolución que se usa como referencia, que suele ser una base).
Puede calcularse con precisión a partir de la segunda derivada de la curva de valoración encontrando los puntos de inflexión (donde la gráfica cambia de concavidad); sin embargo, en la mayoría de los casos, bastará una simple inspección visual de la curva. En la curva de la imagen de la derecha, ambos puntos de equivalencia son visibles, después de añadir aproximadamente 15 y 30 mL de disolución de hidróxido sódico se ha valorado la disolución de ácido oxálico. Para calcular los valores de pKa (constantes de acidez), debemos encontrar el volumen para el punto de semi-equivalencia , es decir cuando se ha añadido la mitad de la cantidad de sustancia titulante necesaria para formar el compuesto (aquí, oxalato monosódico, y luego oxalato disódico). Estas cantidades que son la mitad del punto de equivalencia son 7.5 mL y 22.5 mL, y los valores de pH observado son aproximadamente 1,5 y 4,0; y nos dan los valores de pKa para ese ácido.
Para ácidos monopróticos, el punto a mitad de camino entre el comienzo de la curva (antes de empezar a añadir la disolución estándar) y el punto de equivalencia es significativo: en ese punto, las concentraciones de las dos especies (el ácido y la base conjugada) son iguales. Por tanto, permite resolver la ecuación de Henderson-Hasselbalch de esta manera:
Las definiciones de estas variables son:
![pH = - \log [{H^+}] \,](/pictures/eswiki/101/e577e484948188f080d762c268e86319.png) por otra parte:
por otra parte: 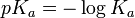 , y finalmente, :
, y finalmente, :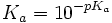
Podemos pues encontrar con facilidad la constante de disociación del ácido monoprótico encontrando el pH del punto a mitad de camino entre el comienzo de la curva y el punto de equivalencia, y resolviendo la ecuación simplificada.
En el caso de una curva de ejemplo, con un pH en el punto de semiequivalencia de 4,75. Eso nos daría un Ka que sería aproximadamente:
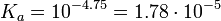 (el Ka real es 1.7×10-5)
(el Ka real es 1.7×10-5)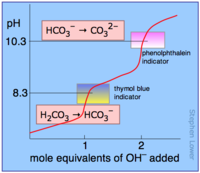 Curva de valoración de un ácido diprótico, ácido carbónico, titulado con una base fuerte, hidróxido sódico. Son visibles los dos puntos de equivalencia, para valores de pH de 8,3 y 10,3 que se manifestarían mediante el viraje de color de los dos indicadores usados
Curva de valoración de un ácido diprótico, ácido carbónico, titulado con una base fuerte, hidróxido sódico. Son visibles los dos puntos de equivalencia, para valores de pH de 8,3 y 10,3 que se manifestarían mediante el viraje de color de los dos indicadores usados
Para ácidos polipróticos, el cálculo de las constantes de disociación del ácido es algo diferente:
- la primera constante de disociación se calcula de misma manera que para ácidos monopróticos.
- la segunda constante de disociación se calcula, sin embargo, como el punto a mitad de camino entre el primer y el segundo punto de equivalencia. Y así sucesivamente para ácidos que ceden más de dos protones, como el ácido fosfórico.
- Otra clase o tipo de titulación o valoración puede usarse para determinar la concentración de un virus o bacteria. La muestra original se diluye (según una razón conocida, como 1:1, 1:2, 1:4, 1:8, etc.) hasta que la última dilución no da positivo en la prueba de presencia del virus. Este valor, el título, se usa en pruebas como TCID50, EID50, ELD50, LD50 o PFU. A este procedimiento se le llama también bioensayo.
Tipos de titulación o valoración
Las valoraciones se clasifican por el tipo de objeto a analizar:
- Valoración ácido-base basadas en la reacción de neutralización entre el analito y una disolución de ácido o base que sirve de referencia. Para determinar el punto final, usan un indicador de pH, un pH-metro, o un medidor de conductancia.
- Valoración redox basadas en la reacción de oxidación-reducción o reacción redox entre el analito y una disolución de oxidante o reductor que sirve de referencia. Para determinar el punto final, usan un potenciómetro o un indicador redox aunque a veces o bien la sustancia a analizar o la disolución estándar de referencia tienen un color suficientemente intenso para que no sea necesario un indicador adicional.
- Valoración complexométrica basadas en la reacción de formación de un complejo entre el analito y la sustancia valorante. El agente quelante EDTA es muy usado para titular iones metálicos en disolución. Estas valoraciones generalmente requieren indicadores especializados que forman complejos más débiles con el analito. Un ejemplo es Negro de Eriocromo T para valoración de iones calcio, magnesio o cobre (II).
- Valoraciones por precipitación: Son aquellas basadas en las reacciones de precipitación.Uno de los tipos más habituales son las Argentometrías: precipitación de aniones como los halógenos ( F-, Cl-, Br-, I-) y el tiocianato (SCN-) con el ión plata. Ag+. Esta titulación está limitada por la falta de indicadores apropiados.[3]
NaX(ac) + AgNO3(ac) → AgX(s) + NaNO3(ac) donde X = F-, Cl-, Br-, I-, SCN-Medida del punto final de una titulación o valoración
Hay diferentes métodos para determinar el punto final o punto de equivalencia:
- Indicadores: Son substancias que cambian de color en respuesta a un cambio químico.
- Indicador de pH o indicador ácido-base: Un indicador ácido-base (como la fenolfthaleína) cambia de color dependiendo del pH del medio.
- Indicador Redox. Una gota de disolución de indicador es añadida al principio de la titulación o valoración; cuando el color cambia, se ha alcanzado el punto final.
- Potenciómetro: Son instrumentos que miden el potencial de electrodo de la disolución. Se usan para valoraciones redox; el potential del electrodo de trabajo cambiará bruscamente en el punto final.
- Medidor de pH o pH-metros: Son potenciómetros que usan un electrodo cuyo potencial depende de la cantidad de ión H+ presente en la disolución. Es un ejemplo de un electrodo de ión selectivo que permite medir el pH de la disolución a lo largo de la valoración. En el punto final, cambiará bruscamente el pH medido. Puede ser un método más preciso que el uso de indicadores, y es fácil de automatizar.
- Conductancia: La conductividad de una disolución depende de los iones presentes en ella. Durante muchas titulaciones, la conductividad cambia de modo significativo. Por ejemplo, durante una valoración ácido-base, los iones H+ y OH- formando agua neutra, H2O. Esto cambia la conductividad de la disolución. La conductancia total de la disolución depende también de los otros iones presentes en la disolución (como los contraiones). No todos ellos contribuyen de igual manera a la conductividad que también dependerá de la movilidad de cada ión y de la concentración total de iones (fuerza iónica). Luego, predecir el cambio en la conductividad es más difícil que medirla.
- Cambio de color: En algunas reacciones, la disolución cambia de color sin presencia de indicador. Es frecuente en valoraciones redox, por ejemplo, cuando los diferentes estados de oxidación de productos y reactivos poseen diferentes colores.
- Precipitación: Si se forma un sólido en la reacción, y luego precipita. Un ejemplo es la reacción entre Ag+ y Cl- que forma una sal muy insoluble, AgCl. Esto dificulta determinar con precisión el punto final. Por ello, a veces se prefiere hacer una titulación inversa.
- Una valoración calorimétrica o titulación isotérmica usa el calor producido o consumido en la reacción para determinar el punto final. Es un método importante en bioquímica, como en la determinación de qué substratos se enlazan a las enzimas.
- Titulación termométrica es una técnica muy versátil. Se diferencia de la anterior por el hecho de que no se determina un aumento o caída de temperatura como indicativo del punto final, sino que se mide la velocidad de cambio de la temperatura.
 Titulación con determinación del punto final por cambio de color
Titulación con determinación del punto final por cambio de color
- Espectroscopía: Puede usarse para medir la absorción de luz por la disolución durante la valoración, y si el espectro del reactivo, sustancia patrón o producto es conocido, podría medirse su evolución con cantidades bastante pequeñas que permitirían conocer el punto final.
- Amperometría o valoración amperométrica: Se usa como técnica de detección analizando la corriente eléctrica debida a la oxidación o reducción de los reactivos o productos en un electrodo de trabajo que dependerá de la concentración de las especies en disolución. El punto final se detecta por un cambio en la corriente. Este método es el más útil cuando hay que reducir un exceso de la sustancia titulante (valoración por retroceso), como es el caso de la valoración de haluros con Ag+.
Valoración por retroceso o inversa
El método de valoración por retroceso se usa cuando se invierte el sentido de la valoración, cambiando la sustancia a valorar. En vez de valorar el analito original se añade un exceso conocido de reactivo estándar a la disolución, y luego se valora el exceso. Este método es útil si el punto final de la valoración por retroceso es más fácil de identificar que el punto final de la valoración normal. Se usa también si la reacción entre el analito y la sustancia titulante es muy lenta.
Algunos usos particulares
- La valoración de biocombustible es el acto de determinar la acidez de una muestra de combustible de origen vegetal mediante la adición de una base a la muestra mientras se comprueba con papel indicador que el pH final es 7. Sabiendo cuánta base neutraliza una cantidad de biocombustible, conoceremos cuanta base en total añadiremos al lote completo.
- La titulación en petroquímica o en la industria alimentaria se usa para definir las propiedades de aceites, grasas y substancias similares.[4]
Algunas valoraciones aplicables a lípidos
- Número ácido: Determina el nivel de ácidos grasos libres presentes en un biocombustible. El número ácido total es la cantidad de base, expresada en miligramos de hidróxido de potasio que se requiere para neutralizar todos los componentes acídicos presentes en un gramo de muestra.
- Grado de acidez: Se realiza una titulación ácido-base con indicador de cambio de color para determinar el contenido de ácido graso libre en una muestra y comprobar así su acidez.
- Número de iodo o Índice de yodo: Es una medida del grado de insaturación de los componentes de una grasa. Será tanto mayor cuanto mayor sea el número de dobles enlaces C=C por unidad de grasa, utilizándose por ello para comprobar la pureza y la identidad de las grasas. Es la cantidad (gramos) de yodo absorbidos por 100 gramos de grasa.
El número de yodo oscila entre 0 (ácidos grasos saturados) a 350. Una valoración redox con cambio de color permite indicar la cantidad de ácido graso insaturado libre en una muestra.[5]
- Número de saponificación: La saponificación consiste en una hidrólisis alcalina de una muestra grasa (con KOH o NaOH). Los lípidos derivados de ácidos grasos (ácidos monocarboxílicos de cadena larga) dan lugar a sales alcalinas (jabones) y alcohol, que son fácilmente extraíbles en medio acuoso.
El número de saponificación no es más que los miligramos de KOH necesarios para saponificar 1 gramo de materia grasa. Esta prueba es otra prueba cualitativa que podemos aplicar a los lípidos. Esta nos permite ver si el tipo de lípido es saponificable (contiene ácidos grasos) o no (no contiene ácidos grasos). Se realiza una valoración ácido-base por retroceso con indicador de cambio de color o valoración potenciométrica para obtener una idea de la longitud media de la cadena de ácidos grasos en una grasa.
Véase también
Referencias
- ↑ Principios del análisis volumétrico [1]
- ↑ Louis Rosenfeld. Four Centuries de Clinical Chemistry. CRC Press, 1999, p. 72-75.
- ↑ Presentación (ppt) sobre volumetrías. Ver enlace [2]
- ↑ Ejemplos de valoración en petroquímica o en la industria alimentaria [3].
- ↑ Caracterización de lípidos. http://www.pucmmsti.edu.do/cienciasfisiologicas/LIPIDOS-SIB.PDF
Enlaces externos
- Science aid: Titration una explicación simple de la titulación o valoración dirigida a jóvenes (en Inglés)
- Titulación o valoración - Instrumental, técnica y cálculos (en Inglés)
- Titulación o valoración - Simulación de curvas pH vs. volumen, diagramas de distribución y análisis de datos reales (en Inglés)
- Monografía Metrohm: Práctica de titulación o valoración
- Monografía Metrohm: Práctica de titulación de un termómetro
- Fundamentos de titulación o valoración: Guía (pdf-en Inglés) de METTLER TOLEDO
Categorías: Wikipedia:Fusionar | Química analítica
Wikimedia foundation. 2010.

![pH = pK_a + \log \left( \frac{[\mbox{base}]}{[\mbox{acido}]} \right)](/pictures/eswiki/53/558de05791c15082741f7b62ac63dfd7.png)