- Ley de los gases ideales
-
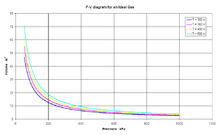
La ley de BOYLE es la ecuación de estado del gas ideal, un gas hipotético formado por partículas puntuales, sin atracción ni repulsión entre ellas y cuyos choques son perfectamente elásticos (conservación de momento y energía cinética). La energía cinética es directamente proporcional a la temperatura en un gas ideal. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Empíricamente, se observan una serie de relaciones entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834.
Contenido
La ecuación de estado
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:
Donde:
 = Presión absoluta(medida en atmósferas)
= Presión absoluta(medida en atmósferas) = Volumen (en esta ecuación el volumen se expresa en litros)
= Volumen (en esta ecuación el volumen se expresa en litros) = Moles de Gas
= Moles de Gas = Constante universal de los gases ideales
= Constante universal de los gases ideales = Temperatura absoluta
= Temperatura absoluta
Teoría cinética molecular
Esta teoría fue desarrollada por Ludwig Boltzmann y Maxwell. Nos indica las propiedades de un gas ideal a nivel molecular.
- Todo gas ideal está formado por N pequeñas partículas puntuales (átomos o moléculas).
- Las moléculas gaseosas se mueven a altas velocidades, en forma recta y desordenada.
- Un gas ideal ejerce una presión continua sobre las paredes del recipiente que lo contiene, debido a los choques de las partículas con las paredes de este.
- Los choques moleculares son perfectamente elásticos. No hay pérdida de energía cinética.
- No se tienen en cuenta las interacciones de atracción y repulsión molecular.
- La energía cinética media de la translación de una molécula es directamente proporcional a la temperatura absoluta del gas.
En estas circunstancias, la ecuación de los gases se encuentra teóricamente:
donde κB es la constante de Boltzmann, donde N es el número de partículas.
La ecuación de estado para gases reales
Valores de R 








Haciendo una corrección a la ecuación de estado de un gas ideal, es decir, tomando en cuenta las fuerzas intermoleculares y volúmenes intermoleculares finitos, se obtiene la ecuación para gases reales, también llamada ecuación de Van der Waals:
Donde:
 = Presión del gas
= Presión del gas = Volumen del gas
= Volumen del gas = Número de moles de gas
= Número de moles de gas = Constante universal de los gases ideales
= Constante universal de los gases ideales = Temperatura del gas
= Temperatura del gas y
y  son constantes determinadas por la naturaleza del gas con el fin de que haya la mayor congruencia posible entre la ecuación de los gases reales y el comportamiento observado experimentalmente.
son constantes determinadas por la naturaleza del gas con el fin de que haya la mayor congruencia posible entre la ecuación de los gases reales y el comportamiento observado experimentalmente.
Ecuación general de los gases ideales
Partiendo de la ecuación de estado:
Tenemos que:
Donde R es la constante universal de los gases ideales, luego para dos estados del mismo gas, 1 y 2:
Para una misma masa gaseosa (por tanto, el número de moles «n» es constante), podemos afirmar que existe una constante directamente proporcional a la presión y volumen del gas, e inversamente proporcional a su temperatura.
Formas alternativas
Como la cantidad de sustancia podría ser dada en masa en lugar de moles, a veces es útil una forma alternativa de la ley del gas ideal. El número de moles (n) es igual a la masa (m) dividido por la masa molar (M):
y sustituyendo
 , obtenemos:
, obtenemos:donde:
Esta forma de la ley del gas ideal es muy útil porque se vincula la presión, la densidad ρ = m/ V, y la temperatura en una fórmula única, independiente de la cantidad del gas considerado.
En mecánica estadística las ecuaciones moleculares siguientes se derivan de los principios básicos:
Aquí k es el constante de Boltzmann y N es el número actual de moléculas, a diferencia de la otra fórmula, que utiliza n, el número de moles. Esta relación implica que Nk = nR, y la coherencia de este resultado con el experimento es una buena comprobación en los principios de la mecánica estadística.
Desde aquí podemos observar que para que una masa de la partícula promedio de μ veces la constante de masa atómica m U (es decir, la masa es μ U)
y desde ρ = m/ V, nos encontramos con que la ley del gas ideal puede escribirse como:
Derivaciones
Empíricas
La ley de gases ideales se puede derivar de la combinación de dos leyes de gases empíricas: la ley de gas y la ley de Avogadro. La combinación de estados de ley de los gases que
donde C es una constante que es directamente proporcional a la cantidad de gas, n (ley de Avogadro). El factor de proporcionalidad es la constante universal de gases, R, i.e. C = nR.
De ahí que la ley del gas ideal
Teóricas
La ley del gas ideal también se puede derivar de los primeros principios utilizando la teoría cinética de los gases, en el que se realizan varios supuestos simplificadores, entre los que las moléculas o átomos del gas son masas puntuales, poseen masa pero no volumen significativo, y se someten a colisiones elásticas sólo entre sí y con los lados del recipiente en el que se conserva tanto la cantidad de movimiento como la energía cinética.
- Se puede hacer una derivación aún más simple prescindiendo de algunos de estos supuestos, como se discutió en la derivación de la ley del gas ideal. Sólo se necesita la definición de temperatura, que el número de partículas sea fijo, que el volumen de la dependencia de las energías de su interacción sea insignificante, y que el número de estados disponibles para cada partícula a una temperatura fija sea proporcional al volumen.) Como en todas las derivaciones termodinámicas, se asume la segunda ley (maximización de la entropía dentro de las limitaciones). No hay hipótesis sobre las colisiones elásticas se requieren, lo cual es bueno ya que estos supuestos son irreales e irrelevantes para el estado de los gases ideales, como se discute: derivación de la ley del gas ideal
Desde la mecánica estadística
Que q = (qx, qy, qz) and p = (px, py, pz) indique el vector de posición y el vector del movimiento de una partícula de un gas ideal, respectivamente. Que F indique la fuerza neta sobre la partícula. Entonces, el tiempo medio de impulso de la partícula es::

donde la primera igualdad es la segunda ley de Newton, y la de segunda línea usa la ecuación de Hamilton y el teorema de equipartición. Sumando sobre un sistema de N, los rendimientos de las partículasPor tercera ley de Newton y la hipótesis del gas ideal, la fuerza neta sobre el sistema es la la fuerza aplicada por los muros de su contenedor y esta fuerza está dada por la presión Pdel gas. Por lo tanto:
Procesos gaseosos particulares
Procesos realizados manteniendo constante un par de sus cuatro variables (n, P , V, T), de forma que queden dos; una libre y otra dependiente. De este modo, la fórmula arriba expuesta para los estados 1 y 2, puede ser operada simplificando 2 o más parámetros constantes. Según cada caso, reciben los nombres:
Ley de Boyle-Mariotte
También llamado proceso isotérmico. Afirma que, a temperatura y cantidad de gas constante, la presión de un gas es inversamente proporcional a su volumen:
Leyes de Charles y Gay-Lussac
En 1802, Louis Gay Lussac publica los resultados de sus experimentos, basados en los que Jacques Charles hizo en el 1787. Se considera así al proceso isobárico para la Ley de Charles, y al isocoro (o isostérico) para la ley de Gay Lussac.
Proceso isobaro (Charles)
Proceso isocoro ( Gay Lussac)
Ley de Avogadro
La Ley de Avogadro fue expuesta por Amedeo Avogadro en 1811 y complementaba a las de Boyle, Charles y Gay-Lussac. Asegura que en un proceso a presión y temperatura constante (isobaro e isotermo), el volumen de cualquier gas es proporcional al número de moles presente, de tal modo que:
Esta ecuación es válida incluso para gases ideales distintos. Una forma alternativa de enunciar esta ley es:
El volumen que ocupa un mol de cualquier gas ideal a una temperatura y presión dadas siempre es el mismo.
Véase también
Referencias
- Schiavello, Mario; Vicente Ribes, Leonardo Palmisano (2003). Fundamentos de Química. Barcelona: Editorial Ariel, S.A.. ISBN 978-84-344-8063-6.
- Rogero, Abrahams; Antoine DuChamper, Alexander Planz (1987). Modelos de predicción molecular para ingenieros.
Enlaces externos
- Valores de la constante de los gases del NIST
Categorías:- Principios y leyes físicas
- Principios y leyes químicas
Wikimedia foundation. 2010.