- Carbonato de magnesio
-
Carbonato de magnesio General Imagen 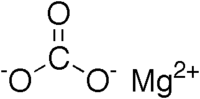
Otros nombres sal anhidra: Magnesita
dihidrato: Barringtonita
trihidrato: Nesequehonita
pentahidrato: LansforditaFórmula molecular MgCO3 Masa molar 84.32 g/mol Aspecto Sólido blanco Número CAS [546-93-0] Propiedades Densidad y estado 2.958 g/cm3, sólido Solubilidad en agua 10.6 mg/100 ml Punto de fusión 350 °C decomp. Estructura Estructura cristalina Trigonal Datos termodinámicos Entropía molar estándar
S°sólido65.84 J.K−1.mol−1 Datos de seguridad Clasificación EU no listado Punto de ignisión no inflamable Número RTECS OM2470000 Página de datos suplementarios Datos espectrales UV, IR, NMR, MS Compuestos relacionados Otros cationes Carbonato de calcio
Carbonato de estroncio
Carbonato de barioCompuestos relacionados Artenita
Hidromagnesita
DipingitaExcepto donde diga lo contrario, los datos son de
materiales en su estado natural (a 25 °C, 100 kPa)El carbonato de magnesio es un compuesto químico de fórmula MgCO3. Este sólido blanco existe en la naturaleza como mineral. Existen también varias formas hidratadas y básicas del carbonato de magnesio como minerales. Adicionalmente, el MgCO3 tiene varias aplicaciones y usos.
Contenido
Propiedades
Las formas más comunes de carbonato de magnesio son la sal anhidra llamada magnesita (MgCO3) y el di, tri y penta hidratos conocidos como barringtonita (MgCO3·2H2O), nesquehonita (MgCO3·3H2O), y lansfordita (MgCO3·5H2O), respectivamente. Algunas formas básicas como la artinita (MgCO3·Mg(OH)2·3H2O), hidromagnestita (4MgCO3·Mg(OH)2·4H2O), y dipingita (4MgCO3· Mg(OH)2·5H2O) también existen como minerales. La magnesita está compuesta por cristales trigonales blancos. La sal anhidra es prácticamente insoluble en agua, acetona, y amoníaco. Todas las demás formas de carbonato de magnesio se disuelven en ácidos. El carbonato de magnesio cristaliza en la estructura de calcita donde el Mg2+ está rodeado por seis átomos de oxígeno. El dihidrato tiene una estructura triclínica, mientras el trihidrato tiene una estructura monoclínica. El pentahidrato en un sólido cristalino blanco con cristales monoclínicos.
Reacciones
A pesar que el carbonato de magnesio es obtenido normalmente por explotación minera del mineral magnesita, la sal trihidratada, MgCO3·3H2O, puede ser preparada mezclando soluciones de magnesio e iones de carbonato en atmósfera de dióxido de carbono.
El carbonato de magnesio también puede ser sintetizado exponiendo hidróxido de magnesio a dióxido de carbono bajo presión de 3,5 a 5 atm y a 50 °C, lo cual produce bicarbonato de magnesio soluble:
-
- Mg(OH)2 + 2CO2 → Mg(HCO3)2
- Mg(OH)2 + 2CO2 → Mg(HCO3)2
Luego del filtrado de la solución, este es secado al vacío para producir carbonato de magnesio en la forma de sal hidratada:
-
- Mg2+ + 2HCO3- → MgCO3 + CO2 + H2O
- Mg2+ + 2HCO3- → MgCO3 + CO2 + H2O
Cuando es disuelto con ácido, el carbonato de magnesio se descompone liberando dióxido de carbono:
-
- MgCO3 + 2HCl → MgCl2 + CO2 + H2O
- MgCO3 + H2SO4 → MgSO4 + CO2 + H2O
- MgCO3 + 2HCl → MgCl2 + CO2 + H2O
A altas temperaturas el MgCO3 se descompone en óxido de magnesio y dióxido de carbono. Este proceso es llamado calcinación:
-
- MgCO3 → MgO + CO2
- MgCO3 → MgO + CO2
Usos
Los minerales de magnesita y dolomita son utilizados para producir magnesio y ladrillos refractarios básicos. El MgCO3 es también utilizado en compuestos a prueba de fuego y extintores, cosméticos y dentífricos. Otras aplicaciones son de material de relleno, supresor de humo en plásticos, agente reforzante en goma de neopreno, como agente de secado, laxante y para retener el color en las comidas. Adicionalmente, el carbonado de magnesio de alta pureza es utilizado como antiácido y como aditivo para la sal de mesa, para que escurra mejor.
En 1911 MgCO3 fue agregado por primera vez a la sal para hacerla más escurridiza.[1]
El carbonato de magnesio, conocido más comúnmente como tiza es utilizado para secar las manos en escalada, gimnasia y halterofilia.
Referencias
- ↑ «Morton Salt FAQ». Consultado el 14-05-2007.
- Patnaik, Pradyot (2003). Handbook of Inorganic Chemicals. New York: McGraw Hill.
- Trotman-Dickenson, A.F "(ed.)" (1973). Comprehensive Inorganic Chemistry. Oxford: Pergamon Press.
Enlaces externos
Categorías:- Carbonatos
- Antiácido
- Compuestos de magnesio
-
Wikimedia foundation. 2010.
