- Fosfuro de aluminio
-
Fosfuro de aluminio
Fosfuro de Aluminio 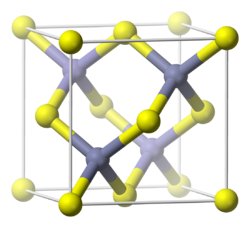
General Nombre: Aluminio (III) phosphina
Aluminio monophosphide
Phostoxin
Fumitoxin
Ferrero FosfuroIdentificación Número CAS 20859-73-8 PubChem 30332 RTECS BD1400000 Propiedades Formula AlP Masa Molar 57.9552 g/mol Apariencia Amarillo o cristales grices Densidad 2,85 g/cm³, solido Solubilidad Reaciona MeltingPt = 2530 °C BoilingPt = Propiedades físicas Estado de la materia Sólido Punto de fusión 317,3 K Punto de ebullición 550 K Entalpía de vaporización 12,129 kJ/mol Entalpía de fusión 0,657 kJ/mol Presión de vapor 20,8 Pa a 294 K Velocidad del sonido sin datos Información diversa ExternalMSDS = External MSDS FlashPt = >800 °C EUClass = Toxic (T); Dangerous for the environment (N) NFPA-F = 4 | NFPA-R = 2 | NFPA-O = WCalor específico 769 J/(kg*K) Conductividad eléctrica 1,0 × 10-9 m-1•Ω-1 Conductividad térmica 0,235 W/(m*K) 1er potencial de ionización 1011,8 kJ/mol 2° potencial de ionización 1907 kJ/mol 3er potencial de ionización 2914,1 kJ/mol 4° potencial de ionización 4963,6 kJ/mol 5° potencial de ionización 6273,9 kJ/mol Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
†Calculado a partir de distintas longitudes
de enlace covalente, metálico o iónico.NFPA 704 El Fosfuro de Aluminio es un compuesto químico con la fórmula AlP. Este solido es generalmente un polvo de color gris/verde/amarillo debido a la precencia de impuresas de su hidrólisis y oxidación. Este material es un amplio band gap semiconductor y es utilizado como insecticida.
Contenido
Estructura, síntesis, y propiedades
AlP cristaliza siguiendo el modelo cúbico del Zinc, donde todos los átomos tienen una coordinación tetraédrica.Materiales relacionados cristalizan de una matera similar, un ejemplo puede ser [Gallium arsenide|GaAs]].
El fosfuro de aluminio puede ser preparado en el laboratorio por la ignición de una mezcla de fosforo rojo y polvo de aluminio.[1]
El fosfuro de alumino reacciona con agua o ácidos para formar fosfina.[2]
- AlP + 3 H2O → Al (OH)3 + PH3
- AlP + 3 H+ → Al3+ + PH3
Pesticida
AlP es usado como rodenticida, insecticida y fumigante para granos almacenados. Es usado para matar pequeños animales mamíferos como los topos, conejos, y roedores. Las tabletas o pelletes contienen tipicamente otros compuestos como amoníaco que ayudan a reducir el riesgo potencial de ignición o explosión del gas de la fosfina. La fosfina pura es inodora pero el grado técnico de posee un desagradable olor a ajo o pescado descompuesto, debido a la presencia de fosfinas o difosfinas sustituídas.(P2H4). El uso como insecticida está muy difundido y se utiliza en para el tratamiento de mercaderías almacenadas previo a su transporte. Puede ser utilizado para el tratamiento de la mayoría de los granos y sus subproductos.
Como rodenticida, los pellets de fosfuro de aluminio son mezclados con la comida de los roedores. El ácido del sistema digestivo de los roedores reacciona con el fosfuro de aluminio para producir la fosfina. Otros pesticidas similares al fosfuro de aluminio son el Fosfuro de zinc y el Fosfuro de calcio.
Como un rodenticida, el fosfuro de aluminio puede ser encontrado bajo los nombres de: Celphos, Fumitoxin, Phostoxin,Gastoxiny Quick Phos y Ferrero Fosfuro.
Aplicaciones como Semiconductor
Industrialmente el , AlP es un material semiconductor usualmente en aleación con otros materiales binarios para la aplicacion en componentes como el diodo (e.j. aluminium gallium indium phosphide).[3]
El Fosfuro de Aluminio con el contacto con el aire sublima para producir fosfina e hidroxido de aluminio.
Composición
El Fosfuro de Aluminio esta compuesto por Fósforo y Aluminio, formando la molécula de AlP, que en contacto con la humedad ambiente se genera un gas muy tóxico llamado Fosfina (PH3).
La entalpía de formación de este producto es de -166.6 kJ/mol
Esto representa que generará 0,68 ºC/gramo de AlP.
Toxicología
Es un producto muy tóxico. La ingestión es letal.
Referencias
- ↑ Wayne E. White, A. H. Bushey (1953). «Aluminum Phosphide» Inorganic Syntheses. Vol. 4. pp. 23–25. DOI 10.1002/9780470132357.ch7.
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier: Amsterdam 1995. ISBN 0-444-89307-5.
Categorías: Insecticidas | Semiconductores | Compuestos de aluminio | Compuestos de fósforo
Wikimedia foundation. 2010.

