- Núcleo atómico
-
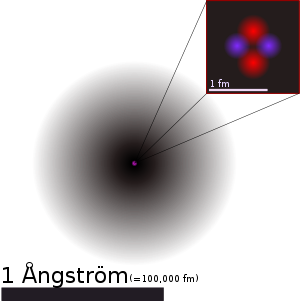
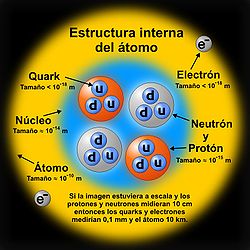
El núcleo atómico es la parte central de un átomo, tiene carga positiva, y concentra más del 99.99% de la masa total del átomo.
Está formado por protones y neutrones (denominados nucleones) que se mantienen unidos por medio de la interacción nuclear fuerte, la cual permite que el núcleo sea estable, a pesar de que los protones se repelen entre sí (como los polos iguales de dos imanes). La cantidad de protones en el núcleo determina el elemento químico al que pertenece. Los núcleos atómicos con el mismo número de protones, pero distinto número de neutrones, se denominan isótopos; por esta razón, átomos de un mismo elemento pueden tener masas diferentes.
La existencia del núcleo atómico fue deducida del experimento de Rutherford, donde se bombardeó una lámina fina de oro con partículas alfa, que son núcleos atómicos de helio emitidos por rocas radiactivas. La mayoría de esas partículas traspasaban la lámina, pero algunas rebotaban, lo cual demostró la existencia de un minúsculo núcleo atómico.
Contenido
Historia
El descubrimiento de los electrones fue la primera indicación de la estructura interna de los átomos. A comienzos del siglo XX el modelo aceptado del átomo era el de JJ Thomson's "pudín de pasas" modelo en el cual el átomo era una gran bola de carga positiva con los pequeños electrones cargados negativamente incrustado dentro de la misma. Por aquel entonces, los físicos habían descubierto también tres tipos de radiaciones procedentes de los átomos : alfa, beta y radiación gamma. Los experimentos de 1911 realizados por Lise Meitner y Otto Hahn, y por James Chadwick en 1914 mostraron que el espectro de decaimiento beta es continuo y no discreto. Es decir, los electrones son expulsados del átomo con una gama de energías, en vez de las cantidades discretas de energía que se observa en rayos gamma y decaimiento alfa. Esto parecía indicar que la energía no se conservaba en estos decaimiento. Posteriormente se descubrió que la energía sí se conserva, con el descubrimiento de los neutrinos.
En 1906 Ernest Rutherford publicó "El retraso de la partícula alfa del radio cuando atraviesa la materia", en Philosophical Magazine (12, p. 134-46). Hans Geiger amplió este trabajo en una comunicación a la Royal Society (Proc. Roy. Soc. 17 de julio de 1908) con experimentos y Rutherford se había hecho pasar aire a través de las partículas α, papel de aluminio y papel de aluminio dorado. Geiger y Marsden publicaron trabajos adicionales en 1909 (Proc. Roy. Soc. A82 p. 495-500) y ampliaron aún más el trabajo en la publicación de 1910 por Geiger (Proc. Roy. Soc. Febrero 1, 1910). En 1911-2 Rutherford explicó ante la Royal Society los experimentos y propuso la nueva teoría del núcleo atómico.
Por esas mismas fechas (1909) Ernest Rutherford realizó un experimento en el que Hans Geiger y Ernest Marsden, bajo su supervisión dispararon partículas alfa (núcleos de helio) en una delgada lámina de oro. El modelo atómico de Thomson predecía que la de las partículas alfa debían salir de la lámina con pequeñas desviaciones de sus trayectorias están. Sin embargo, descubrió que algunas partículas se dispersan a grandes ángulos, e incluso completamente hacia atrás en algunos casos. Este descubrimiento en 1911, llevó al modelo atómico de Rutherford, en que el átomo está constituido por protones y electrones. Así, el átomo del nitrógeno-14 estaría constituido por 14 protones y 7 electrones.
El modelo de Rutherford funcionó bastante bien hasta que los estudios llevadas a cabo por Franco Rasetti, en el Institute of Technology de California en 1929. En 1925 se sabía que los protones y electrones tiene un espín de 1 / 2, y en el modelo de Rutherford nitrógeno - 14 los 14 protones y seis de los electrones deberían cancelar sus contribuciones al espín total, estimándose un espín total de 1 / 2. Rasetti descubierto, sin embargo, que el nitrógeno - 14 tiene un espín total unidad.
En 1930 Wolfgang Pauli no pudo asistir a una reunión en Tubinga, y en su lugar envió una carta famoso con la clásica introducción "Queridos Señoras y señores radiactivos ". En su carta Pauli sugirió que tal vez existía una tercera partícula en el núcleo, que la bautizó con el nombre de "neutrones". Sugirió que era más ligero que un electrón y sin carga eléctrica, y que no interactuaba fácilmente con la materia (y por eso todavía no se le había detectado). Esta hipótesis permitía resolver tanto el problema de la conservación de la energía en la desintegración beta y el espín de nitrógeno - 14, la primera porque los neutrones llevaban la energía no detectada y el segundo porque un electrón extra se acoplaba con el electrón sobrante en el núcleo de nitrógeno - 14 para proporcionar un espín de 1. Enrico Fermi redenominó en 1931 los neutrones de Pauli como neutrinos (en italiano pequeño neutral) y unos treinta años después se demostró finalmente que un neutrinos realmente se emiten en el decaimiento beta.
En 1932 James Chadwick se dio cuenta de que la radiación que de que había sido observado por Walther Bothe, Herbert L. Becker, Irène y Jean Frédéric Joliot-Curie era en realidad debido a una partículas que él llamó el neutrón. En el mismo año Dimitri Ivanenko sugirió que los neutrones eran, de hecho partículas de espín 1 / 2, que existían en el núcleo y que no existen electrones en el mismo, y Francis Perrin sugirió que los neutrinos son partículas nucleares, que se crean durante el decaimiento beta. Fermi publicó 1934 una teoría de los neutrinos con una sólida base teórica. En el mismo año Hideki Yukawa propuso la primera teoría importante de la fuerza para explicar la forma en que el núcleo mantiene junto.
Descripción del núcleo
Forma y tamaño del núcleo
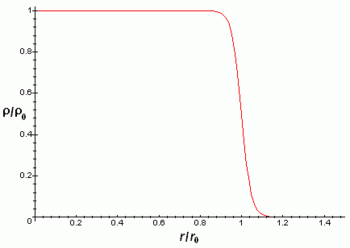
Los núcleos atómicos son mucho más pequeños que el tamaño típico de un átomo (entre 10 mil y 100 mil veces más pequeños). Además contienen más del 99% de la masa con lo cual la densidad másica del núcleo es muy elevada. Los núcleos atómicos tienen algún tipo de estructura interna, por ejemplo los neutrones y protones parecen estar orbitando unos alrededor de los otros, hecho que se manifiesta en la existencia del momento magnético nuclear. Sin embargo, los experimentos revelan que el núcleo se parece mucho a una esfera o elipsoide compacto de 10-15 m (= 1 fm), en el que la densidad parece prácticamente constante. Naturalmente el radio varía según el número de protones y neutrones, siendo los núcleos más pesados y con más partículas algo más grandes. La siguiente fórmula da el radio del núcleo en función del número de nucleones A:

Donde

La densidad de carga eléctrica del núcleo es aproximadamente constante hasta la distancia
 y luego decae rápidamente hasta prácticamente 0 en una distancia
y luego decae rápidamente hasta prácticamente 0 en una distancia  de acuerdo con la fórmula:
de acuerdo con la fórmula:
Donde r es la distancia radial al centro del núcleo atómico.
Las aproximaciones anteriores son mejores para núcleos esféricos, aunque la mayoría de núcleos no parecen ser esféricos como revela que posean momento cuadrupular diferente de cero. Este momento cuadrupolar se manifiesta en la estructura hiperfina de los espectros atómicos y hace que el campo eléctrico del núcleo no sea un campo coulombiano con simetría esférica.
Estabilidad del núcleo
Los núcleos atómicos se comportan como partículas compuestas a energías suficientemente bajas. Además, la mayoría de núcleos atómicos por debajo de un cierto peso atómico y que además presentan un equilibrio entre el número de neutrones y el número de protones (número atómico) son estables. Sin embargo, sabemos que los neutrones aislados y los núcleos con demasiados neutrones (o demasiados protones) son inestables.
La explicación de esta estabilidad de los núcleos reside en la existencia de los piones. Aisladamente los neutrones pueden sufrir vía interacción débil la siguiente desintegración:
(1)

Sin embargo, dentro del núcleo atómico la cercanía entre neutrones y protones hace que sean mucho más rápidas, vía interacción fuerte las reacciones:
(2)

Esto hace que continuamente los neutrones del núcleo se transformen en protones, y algunos protones en neutrones, esto hace que la reacción () apenas tenga tiempo de acontecer, lo que explica que los neutrones de los núcleos atómicos sean mucho más estable que los neutrones aislados. Si el número de protones y neutrones se desequilibra, se abre la posibilidad de que en cada momento haya más neutrones y sea más fácil la ocurrencia de la reacción ().
Modelos de estructura del núcleo atómico
En 1808 el químico inglés John Dalton propone una nueva teoría sobre la constitución de la materia. Según Dalton toda la materia está formada por átomos indivisibles e invisibles, estos a su vez se unen para formar compuestos en proporciones enteras fijas y constantes. De hecho Dalton propuso la existencia de los átomos como una hipótesis para explicar porqué los átomos sólo se combinaban en ciertas combinaciones concretas. El estudio de esas combinaciones le llevó a poder calcular los pesos atómicos. Para Dalton la existencia del núcleo atómico era desconocida y se consideraba que no existían partes más pequeñas.
En 1897 Joseph John Thomson fue el primero en proponer un modelo estructural interno del átomo. Thomson fue el primero en identificar el electrón como partícula subatómica de carga negativa y concluyó que «si los átomos contienen partículas negativas y la materia se presenta con neutralidad de carga, entonces deben existir partículas positivas». Es así como Thomson postuló que el átomo debe ser una esfera compacta positiva en la cual se encontrarían incrustados los electrones en distintos lugares, de manera que la cantidad de carga negativa sea igual a la carga positiva.
Así ni el modelo atómico de Dalton ni el de Thomson incluían ninguna descripción del núcleo atómico. La noción de núcleo atómico surgió en 1911 cuando Ernest Rutherford y sus colaboradores Hans Geiger y Ernest Marsden, utilizando un haz de radiación alfa, bombardearon hojas laminadas metálicas muy delgadas, colocando una pantalla de sulfuro de zinc a su alrededor, sustancia que tenía la cualidad de producir destellos con el choque de las partículas alfa incidentes. La hoja metálica fue atravesada por la mayoría de las partículas alfa incidentes; algunas de ellas siguieron en línea recta, otras fueron desviadas de su camino, y lo más sorprendente, muy pocas rebotaron contra la lámina.
A la luz de la fórmula dispersión usada por Rutherford:
(1)

Donde:
 , siendo ε0 la constante dieléctrica del vacío y
, siendo ε0 la constante dieléctrica del vacío y  , es la carga eléctrica del centro dispersor.
, es la carga eléctrica del centro dispersor. , es la energía cinética inicial de la partícula alfa incidente.
, es la energía cinética inicial de la partícula alfa incidente. es el parámetro de impacto.
es el parámetro de impacto.
Los resultados del experimento requerían parámetros de impacto muy pequeños, y por tanto que el núcleo estuviera concentrado en la parte central, el núcleo de carga positiva, donde estaria concentrada la masa del átomo. con ello explicaba la desviación de las partículas alfa (partículas de carga positiva). Los electrones se encontrarían en una estructura externa girando en órbitas circulares muy alejadas del núcleo, lo que explicaría el paso mayoritario de las partículas alfa a través de la lámina de oro.
En 1913 Niels Bohr postula que los electrones giran a grandes velocidades alrededor del núcleo atómico. Los electrones se disponen en diversas órbitas circulares, las cuales determinan diferentes niveles de energía. El electrón puede acceder a un nivel de energía superior, para lo cual necesita "absorber" energía. Para volver a su nivel de energía original es necesario que el electrón emita la energía absorbida (por ejemplo en forma de radiación).
Comúnmente existen dos modelos diferentes describir el núcleo atómico:
- El modelo de la gota de agua
- El modelo de capas
Aunque dichos modelos son mútuamente excluyentes en sus hipótesis básicas tal como fueron formulados originalmente, A. Bohr y Mottelson construyeron un modelo mixto que combinaba fenomenológicamente características de ambos modelos.
Modelo de la gota líquida
Este modelo no pretende describir la compleja estructura interna del núcleo sino sólo las energías de enlace entre neutrones y protones así como algunos aspectos de los estados excitados de un núcleo atómico que se reflejan en los espectros nucleares. Fue inicialmente propuesto por Bohr (1935) y el núcleo en analogía con una masa de fluido clásico compuesto por neutrones y protones y una fuerza central columbiana repulsiva proporcional al número de protones Z y con origen en el centro de la gota.
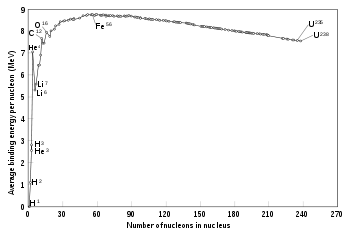
Desde el punto de vista cuantitativo se observa que la masa de un núcleo atómico es inferior a la masa de los componentes indiviudales (protones y neutrones) que lo forman. Esta no conservación de la masa está conectada con la ecuación E = mc2 de Einstein, por la cual parte de la masa está en forma de energía de ligazón entre dichos componentes. Cuantiativamente se tiene la siguiente ecuación:[1]

Donde:
 son respectivamente la masa del núcleo, la masa de un protón y la masa de un neutrón.
son respectivamente la masa del núcleo, la masa de un protón y la masa de un neutrón. son respectivamente el número atómico (que coincide con el número de protones), el número másico (que coincide con el número de nucleones) y A-Z por tanto coincide con el número de neturones.
son respectivamente el número atómico (que coincide con el número de protones), el número másico (que coincide con el número de nucleones) y A-Z por tanto coincide con el número de neturones. es la energía de enlace entre todos los nucleones.
es la energía de enlace entre todos los nucleones.
El modelo de la gota de agua pretende describir la energía de enlace B a partir de consideraciones geométricas e interpreta la energía de los estados excitados de los núcleos como rotaciones o vibraciones semiclásicas de la "gota de agua" que representa el núcleo. En concreto en este modelo la energía de enlace se representa como B:[2]

Donde:
 este término representa el efecto favorable del volumen.
este término representa el efecto favorable del volumen. este término representa el efecto desfavorable de la superficie.
este término representa el efecto desfavorable de la superficie. representa el efecto de la repulsión coulombiana entre protones.
representa el efecto de la repulsión coulombiana entre protones. representa el hecho de que los núcleos "equilibrados" con un número similar de protones y neutrones son más estables.
representa el hecho de que los núcleos "equilibrados" con un número similar de protones y neutrones son más estables. representa el hecho de que los núcleos con un número par de protones y neutrones, son más estables que los que tienen un número impar de ambas especies. Matemáticamente el término viene dado por:
representa el hecho de que los núcleos con un número par de protones y neutrones, son más estables que los que tienen un número impar de ambas especies. Matemáticamente el término viene dado por:
Modelo de capas
Este es un modelo que trata de capturar parte de la estructura interna reflejada tanto en el momento angular del núcleo, como en su momento angular. Además el modelo pretende explicar porqué los núcleos con un "número mágico" de nucleones (neutrones y protones) resultan más estables (los números mágicos son 2, 8, 20, 28, 50, 82 y 126).
La explicación del modelo es que los nucleones se agrupan en "capas". Cada capa está formada por un conjunto de estados cuánticos con energías similares, la diferencia de energía entre dos capa es grande comparada con las variaciones de energía dentro de cada capa. Así dado que los nucleones son fermiones un núcleo atómico tendrá las capas de menor energía llena por lo que los nucleones no pueden caer a capas inferiores ya llenas. Las capas aquí deben entenderse en un sentido abstracto y no como capas físicas como las capas de una cebolla, de hecho la forma geométrica del espacio ocupado por un nucleón en un determinado estado de una capa se interpenetra con el espacio ocupado por nucleones de otras capas, de manera análoga a como las capas electrónicas se interpenetran en un átomo.
Referencias
Bibliografía
- C. Sánchez del Río (2003). «Estructura de los núcleos atómicos». En C. Sánchez del Río. Física cuántica. Ediciones Pirámide. pp. 882-899. ISBN 978-84-368-1656-3.
Véase también
- Estructura nuclear
- Fisión y fusión nuclear
- Acelerador de partículas
- Radio nuclear
Wikimedia foundation. 2010.