- Interacción catión-pi
-
Interacción catión-pi
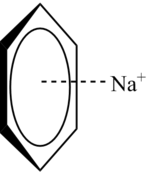
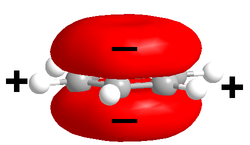
La interacción catión-π es una interacción molecular no covalente entre la cara de un sistema pi rico en electrones (vg. benceno, etileno) con un catión adyacente (vg. Li+, Na+). Esta interacción inusual es un ejemplo de enlace no covalente entre un monopolo (catión) y un cuadrupolo (sistema π). La energía de la interacción catión-π es del mismo orden de magnitud del enlace de hidrógeno o del puente salino, y juega un rol importante en el reconocimiento molecular.[1]
.
Contenido
Origen del Efecto
El benceno, sistema π modelo, no tiene un momento dipolar permanente, pues las contribuciones de los enlaces carbono-hidrógeno débilmente polares se cancelan debido a la simetría molecular. Sin embargo, el sistema π rico en electrones sobre y debajo del anillo de benceno implica una carga negativa parcial. Como contrabalance, hay carga positiva asociada en el plano donde yacen todos los átomos de benceno, con lo que resulta un cuadrupolo eléctrico (un par de dipolos, que no se cancelan entre sí). El sistema π cargado negativamente puede interactuar favorablemente con los iones cargados positivamente.
Factores que influyen en la fuerza de la interacción catión-π
La interacción catión-π es comparable en fuerza al enlace de hidrógeno y puede, en algunos casos, ser una fuerza intermolecular decisiva. Algunos criterios influyen en la fuerza del enlace: la naturaleza del catión, los sustituyentes en el sistema π, así como el solvente.
Naturaleza del catión
A partir de simples consideraciones electrostáticas, (ley de Coulomb), los cationes pequeños y con mayor carga positiva conducen a atracciones electrostáticas más fuertes. La siguiente tabla muestra una serie de cambios en la energía libre de Gibbs para la interacción del benceno con algunos metales alcalinos en la fase gaseosa.[2] La influencia del radio iónico, rion, es evidente.
M+ Li+ Na+ K+ Rb+ -ΔG [kcal/mol] 38 27 19 16 rion [pm] 76 102 138 152 Sustituyentes en el sistema π
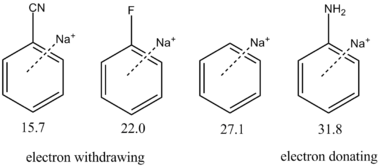
Las propiedades electrónicas de los sustituyentes en el sistema π también están ejercen influencia en la fuerza de la atracción. Los grupos que atraen electrones (vg. ciano -CN) disminuyen la densidad de carga negativa en el sistema π, con lo que debilitan la interacción. Por el contrario, los grupos que liberan electrones (vg. amino -NH2) incrementan la separación de la carga del cuadrupolo y fortalecen la unión catión-π. Esta relación está ilustratada cuantitativamente al margen, con algunos sustituyentes.
Influencia del solvente
Adicionalmente, la naturaleza del solvente también determina la fuerza relativa del enlace. La mayor parte de la información sobre la interacción catión-π se adquiere en la fase gaseosa, dado que la atracción es más pronunciada en este caso. Cualquier molécula de solvente que intermedie atenuará el efecto, la que se hace menor con el aumento de la polaridad del solvente.
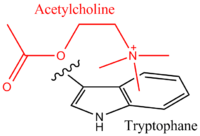 La acetilcolina catiónica se une a un residuo de triptófano del receptor de acetilcolina nicotinamida vía un efecto catión-π.
La acetilcolina catiónica se une a un residuo de triptófano del receptor de acetilcolina nicotinamida vía un efecto catión-π.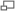
Interacciones catión-π en la naturaleza
Los bloques de construcción de la naturaleza consisten también de entidades aromáticas. Las cadenas laterales de los aminoácidos triptófano y tirosina, o los nucleótidos son capaces de unirse a especies catiónicas (no sólo con iones metálicos, sino también con cadenas laterales cargadas de otros aminoácidos, ...).[4] [5]
En consecuencia, las interacciones catión-π pueden jugar un rol importante en la estabilización de la estructura tridimensional de una proteína. Un papel alternativo de la interacción catión-π se ve en un receptor nicotínico de acetilcolina, que une a su ligando endógeno, acetilcolina (una molécula con carga positiva), vía una interacción catión-π al amonio cuaternario.[6]
Interacción anión-π
En muchos aspectos, la interacción anión-π es opuesta a la interacción catión-π, aunque los principios subyacentes son idénticos. Se conocen muy pocos ejemplos a la fecha. Con el fin de atraer una carga negativa, la distribución de carga del sistema π debe estar invertida. Esto se consigue colocando algunos grupos que atraen electrones fuertes junto al sistema π (vg., hexafluorobenceno).[7] El efecto anión-π es explotado más ventajosamente en sensores químicos para aniones específicos.[8]
Notas
- ↑ Eric V. Anslyn, Dennis A. Dougherty (2004). Modern Physical Organic Chemistry. University Science Books. ISBN 9-78-891389-31-3
- ↑ J. C. Amicangelo, and P. B. Armentrout (2000). «Absolute Binding Energies of Alkali-Metal Cation Complexes with Benzene Determined by Threshold Collision-Induced Dissociation Experiments and ab Initio Theory» J. Phys. Chem. A. Vol. 104. n.º 48. pp. 11420. DOI 10.1021/jp002652f.
- ↑ S. Mecozzi, A. P. West, and D. A. Dougherty (1996). «Cation-π Interactions in Simple Aromatics: Electrostatics Provide a Predictive Tool» JACS. Vol. 118. n.º 9. pp. 2307. DOI 10.1021/ja9539608.
- ↑ M. M. Gromiha, C. Santhosh, and S. Ahmad (2004). «Structural analysis of cation-π interactions in DNA binding proteins» Int. J. Biol. Macromol.. Vol. 34. n.º 3. pp. 203. DOI 10.1016/j.ijbiomac.2004.04.003.
- ↑ J. P. Gallivan and D. A. Dougherty (1999). «Cation-π interactions in structural biology» PNAS. Vol. 96. n.º 17. pp. 9459. DOI 10.1073/pnas.96.17.9459.
- ↑ D. L. Beene, G. S. Brandt, W. Zhong, N. M. Zacharias, H. A. Lester, and D. A. Dougherty (2002). «Cation-π Interactions in Ligand Recognition by Serotonergic (5-HT3A) and Nicotinic Acetylcholine Receptors: The Anomalous Binding Properties of Nicotine» Biochemistry. Vol. 41. n.º 32. pp. 10262. DOI 10.1021/bi020266d.
- ↑ D. Quiñonero, C. Garau, C. Rotger, A. Frontera, P. Ballester, A. Costa, and P. M. Deyà (2002). «Anion-π Interactions: Do They Exist?» Angew. Chem. Int. Ed.. Vol. 41. n.º 18. pp. 3389. DOI <3389::AID-ANIE3389>3.0.CO;2-S 10.1002/1521-3773(20020916)41:18<3389::AID-ANIE3389>3.0.CO;2-S.
- ↑ P. de Hoog, P. Gamez, I. Mutikainen, U. Turpeinen, and J. Reedijk (2004). «An Aromatic Anion Receptor: Anion-π Interactions do Exist» Angew. Chem.. Vol. 116. n.º 43. pp. 5939. DOI 10.1002/ange.200460486.
Referencias
- J. C. Ma, and D. A. Dougherty (1997). «The Cation-π Interaction» Chem. Rev.. Vol. 97. n.º 5. pp. 1303. DOI 10.1021/cr9603744..
- Plantilla:Cite pmid
Véase también
- Stacking
Categoría: Enlace químico
Wikimedia foundation. 2010.