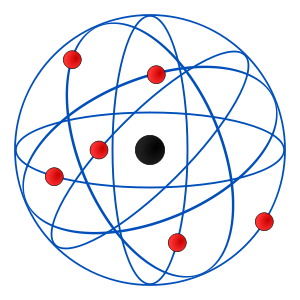
- Modelo atómico de Rutherford
-
El modelo atómico de Rutherford es un modelo atómico o teoría sobre la estructura interna del átomo propuesto por el químico y físico británico-neozelandés Ernest Rutherford para explicar los resultados de su "experimento de la lámina de oro", realizado en 1911.
El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo", muy pequeño, que concentra toda la carga eléctrica positiva y casi toda la masa del átomo.
Contenido
Introducción
Antes de la propuesta de Rutherford, los físicos aceptaban que las cargas eléctricas en el átomo tenían una distribución más o menos uniforme. Rutherford trató de ver cómo era la dispersión de las partículas alfa por parte de los átomos de una lámina de oro muy delgada. Los ángulos resultantes de la desviación de las partículas supuestamente aportarían información sobre cómo era la distribución de carga en los átomos. Era de esperar que, si las cargas estaban distribuidas uniformemente según el modelo atómico de Thomson, la mayoría de las partículas atravesarían la delgada lámina sufriendo sólo ligerísimas deflexiones, siguiendo una trayectoria aproximadamente recta. Aunque esto era cierto para la mayoría de las partículas alfa, un número importante de estas sufrían deflexiones de cerca de 180º, es decir, prácticamente salían rebotadas en dirección opuesta a la incidente.
Rutherford pensó que esta fracción de partículas rebotadas en dirección opuesta podía ser explicada si se suponía la existencia de fuertes concentraciones de carga positiva en el átomo. La mecánica newtoniana en conjunción con la ley de Coulomb predice que el ángulo de deflexión de una partícula alfa relativamente liviana por parte de un átomo de oro más pesado, depende del "parámetro de impacto" o distancia entre la trayectoria de la partícula y el núcleo:[1]
(1)

Donde:
 , siendo ε0 la constante dieléctrica del vacío y
, siendo ε0 la constante dieléctrica del vacío y  la carga eléctrica del centro dispersor.
la carga eléctrica del centro dispersor. , es la energía cinética inicial de la partícula alfa incidente.
, es la energía cinética inicial de la partícula alfa incidente. es el parámetro de impacto.
es el parámetro de impacto.
Dado que Rutherford observó una fracción apreciable de partículas "rebotadas" para las cuales el ángulo de deflexión es cercano a χ ≈ π, de la relación inversa a ():
(2)

se deduce que el parámetro de impacto debe ser bastante menor que el radio atómico. De hecho el parámetro de impacto necesario para obtener una fracción apreciable de partículas "rebotadas" sirvió para hacer una estimación del tamaño del núcleo atómico, que resulta ser unas cien mil veces más pequeño que el diámetro atómico.
Importancia del modelo y limitaciones
La importancia del modelo de Rutherford residió en proponer por primera vez la existencia de un núcleo en el átomo (término que, paradójicamente, no aparece en sus escritos). Lo que Rutherford consideró esencial, para explicar los resultados experimentales, fue "una concentración de carga" en el centro del átomo, ya que sin ella, no podía explicarse que algunas partículas fueran rebotadas en dirección casi opuesta a la incidente. Este fue un paso crucial en la comprensión de la materia, ya que implicaba la existencia de un núcleo atómico donde se concentraba toda la carga positiva y más del 99,9% de la masa. Las estimaciones del núcleo revelaban que el átomo en su mayor parte estaba vacío.
Rutherford propuso que los electrones orbitarían en ese espacio vacío alrededor de un minúsculo núcleo atómico, situado en el centro del átomo. Además se abrían varios problemas nuevos que llevarían al descubrimiento de nuevos hechos y teorías al tratar de explicarlos:
- Por un lado se planteó el problema de cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan pequeño, hecho que llevó posteriormente a la postulación y descubrimiento de la fuerza nuclear fuerte, que es una de las cuatro interacciones fundamentales.
- Por otro lado existía otra dificultad proveniente de la electrodinámica clásica que predice que una partícula cargada y acelerada, como sería el caso de los electrones orbitando alrededor del núcleo, produciría radiación electromagnética, perdiendo energía y finalmente cayendo sobre el núcleo. Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de 10 − 10s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.[2] Se trata, por tanto de un modelo físicamente inestable, desde el punto de vista de la física clásica.
Según Rutherford, las órbitas de los electrones no están muy bien definidas y forman una estructura compleja alrededor del núcleo, dándole un tamaño y forma algo indefinidas. Los resultados de su experimento le permitieron calcular que el radio atómico era diez mil veces mayor que el núcleo mismo, y en consecuencia, que el interior de un átomo está prácticamente vacío.
Modelos posteriores
El modelo atómico de Rutherford fue sustituido muy pronto por el de Bohr. Bohr intentó explicar fenomenológicamente que sólo algunas órbitas de los electrones son posibles. Lo cual daría cuenta de los espectros de emisión y absorción de los átomos en forma de bandas discretas.
El modelo de Bohr "resolvía" formalmente el problema, proveniente de la electrodinámica, postulando que sencillamente los electrones no radiaban, hecho que fue explicado por la mecánica cuántica según la cual la aceleración promedio del electrón deslocalizado es nula.
Predecesor:
modelo atómico de Thomson'modelo atómico de Rutherford'
1911 - 1913Sucesor:
modelo atómico de BohrReferencias
- Landau & Lifshitz: Mecánica, Ed. Reverté, Barcelona, p.158 - 175, 1991. ISBN 84-291-4081-6.
Véase también
Categoría:- Modelos atómicos
Wikimedia foundation. 2010.