- Teoría atómica
-
 Varios átomos y moléculas según John Dalton, en su libro A New System of Chemical Philosophy (Nuevo Sistema de Filosofía Química, 1808).
Varios átomos y moléculas según John Dalton, en su libro A New System of Chemical Philosophy (Nuevo Sistema de Filosofía Química, 1808).
En física y química, la teoría atómica es una teoría de la naturaleza de la materia, que afirma que está compuesta por pequeñas partículas llamadas átomos.
La teoría atómica comenzó hace miles de años como un concepto filosófico y fue en el siglo XIX cuando logró una extensa aceptación científica gracias a los descubrimientos en el campo de la estequiometría. Los químicos de la época creían que las unidades básicas de los elementos también eran las partículas fundamentales de la naturaleza y las llamaron átomos (de la palabra griega atomos, que significa "indivisible"). Sin embargo, a finales de aquel siglo, y mediante diversos experimentos con el electromagnetismo y la radiactividad, los físicos descubrieron que el denominado "átomo indivisible" era realmente un conglomerado de diversas partículas subatómicas (principalmente electrones, protones y neutrones), que pueden existir de manera separada. De hecho, en ciertos ambientes, como en las estrellas de neutrones, la temperatura extrema y la elevada presión impide a los átomos existir como tales. El campo de la ciencia que estudia las partículas fundamentales de la materia se denomina física de partículas.
Contenido
Teoría atómica moderna
Nacimiento de la teoría atómica moderna
Durante el siglo XVIII y los primeros años del siglo XIX, en su afán por conocer e interpretar la naturaleza, los científicos estudiaron intensamente las reacciones químicas mediante numerosos experimentos. Estos estudios permitieron hallar relaciones muy precisas entre las masas de las sustancias sólidas o entre los volúmenes de los gases que intervienen en las reacciones químicas. Las relaciones encontradas se conocen como leyes de la química. Entre las leyes fundamentales de la Química, hay algunas que establecen las relaciones entre masas, llamadas leyes gravimétricas y otras que relacionan volúmenes, denominadas leyes volumétricas. John Dalton desarrolló su modelo atómico, en la que proponía que cada elemento químico estaba compuesto por átomos iguales y exclusivos, y que aunque eran indivisibles e indestructibles, se podían asociar para formar estructuras más complejas (los compuestos químicos). Esta teoría tuvo diversos precedentes.
El primero fue la ley de conservación de la masa, formulada por Antoine Lavoisier en 1789, que afirma que la masa total en una reacción química permanece constante. Esta ley le sugirió a Dalton la idea de que la materia era indestructible.
El segundo fue la ley de las proporciones definidas. Enunciada por el químico francés Joseph Louis Proust en 1799, afirma que, en un compuesto, los elementos que lo conforman se combinan en proporciones de masa definidas y características del compuesto.
Dalton estudió y amplió el trabajo de Proust para desarrollar la ley de las proporciones múltiples: cuando dos elementos se combinan para originar diferentes compuestos, dada una cantidad fija de uno de ellos, las diferentes cantidades del otro se combinan con dicha cantidad fija para dar como producto los compuestos, están en relación de números enteros sencillos.
En 1803, Dalton publicó su primera lista de pesos atómicos relativos para cierta cantidad de sustancias. Esto, unido a su rudimentario material, hizo que su tabla fuese muy poco precisa. Por ejemplo, creía que los átomos de oxígeno eran 5,5 veces más pesados que los átomos de hidrógeno, porque en el agua midió 5,5 gramos de oxígeno por cada gramo de hidrógeno y creía que la fórmula del agua era HO (en realidad, un átomo de oxígeno es 16 veces más pesado que un átomo de hidrógeno).
La ley de Avogadro le permitió deducir la naturaleza diatómica de numerosos gases, estudiando los volúmenes en los que reaccionaban. Por ejemplo: el hecho de que dos litros de hidrógeno reaccionasen con un litro de oxígeno para producir dos litros de vapor de agua (a presión y temperatura constantes), significaba que una única molécula de oxígeno se divide en dos para formar dos partículas de agua. De esta forma, Avogadro podía calcular estimaciones más exactas de la masa atómica del oxígeno y de otros elementos, y estableció la distinción entre moléculas y átomos.
Ya en 1784, el botánico escocés Robert Brown, había observado que las partículas de polvo que flotaban en el agua se movían al azar sin ninguna razón aparente. En 1905, Albert Einstein tenía la teoría de que este movimiento browniano lo causaban las moléculas de agua que "bombardeaban" constantemente las partículas, y desarrolló un modelo matemático hipotético para describirlo. El físico francés Jean Perrin demostró experimentalmente este modelo en 1911, proporcionando además la validación a la teoría de partículas (y por extensión, a la teoría atómica).
Descubrimiento de las partículas subatómicas
 El tubo de rayos catódicos de Thomson, en el que observó la desviación de los rayos catódicos por un campo eléctrico.
El tubo de rayos catódicos de Thomson, en el que observó la desviación de los rayos catódicos por un campo eléctrico.
Hasta 1897, se creía que los átomos eran la división más pequeña de la materia, cuando J.J Thomson descubrió el electrón mediante su experimento con el tubo de rayos catódicos.[1] El tubo de rayos catódicos que usó Thomson era un recipiente cerrado de vidrio, en el cual los dos electrodos estaban separados por un vacío. Cuando se aplica una diferencia de tensión a los electrodos, se generan rayos catódicos, que crean un resplandor fosforescente cuando chocan con el extremo opuesto del tubo de cristal. Mediante la experimentación, Thomson descubrió que los rayos se desviaban al aplicar un campo eléctrico (además de desviarse con los campos magnéticos, cosa que ya se sabía). Afirmó que estos rayos, más que ondas, estaban compuestos por partículas cargadas negativamente a las que llamó "corpúsculos" (más tarde, otros científicos las rebautizarían como electrones).
Thomson creía que los corpúsculos surgían de los átomos del electrodo. De esta forma, estipuló que los átomos eran divisibles, y que los corpúsculos eran sus componentes. Para explicar la carga neutra del átomo, propuso que los corpúsculos se distribuían en estructuras anilladas dentro de una nube positiva uniforme; éste era el modelo atómico de Thomson o "modelo del plum cake".[2]
Ya que se vio que los átomos eran realmente divisibles, los físicos inventaron más tarde el término "partículas elementales" para designar a las partículas indivisibles.
Descubrimiento del núcleo
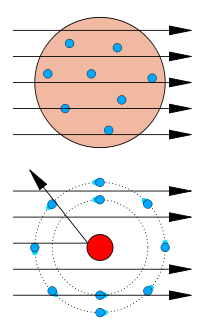 Experimento de la lámina de oro
Experimento de la lámina de oro
Arriba: Resultados esperados: las partículas alfa pasan sin problemas por el modelo atómico de Thomson.
Abajo: Resultados observados: una pequeña parte de las partículas se desvía, lo que revela la existencia de un lugar en el átomo donde se concentra la carga positiva.El modelo atómico de Thomson fue refutado en 1909 por uno de sus estudiantes, Ernest Rutherford, quien descubrió que la mayor parte de la masa y de la carga positiva de un átomo estaba concentrada en una fracción muy pequeña de su volumen, que suponía que estaba en el mismo centro.
En su experimento, Hans Geiger y Ernest Marsden bombardearon partículas alfa a través de una fina lámina de oro (que chocarían con una pantalla fluorescente que habían colocado rodeando la lámina).[3] Dada la mínima como masa de los electrones, la elevada masa y momento de las partículas alfa y la distribución uniforme de la carga positiva del modelo de Thomson, estos científicos esperaban que todas las partículas alfa atravesasen la lámina de oro sin desviarse, o por el contrario, que fuesen absorbidas. Para su asombro, una pequeña fracción de las partículas alfa sufrió una fuerte desviación. Esto indujo a Rutherford a proponer el modelo planetario del átomo, en el que los electrones orbitaban en el espacio alrededor de un gran núcleo compacto, a semejanza de los planetas y el Sol.[4]
Descubrimiento de los isótopos
En 1913, Thomson canalizó una corriente de iones de neón a través de campos magnéticos y eléctricos, hasta chocar con una placa fotográfica que había colocado al otro lado. Observó dos zonas incandescentes en la placa, que revelaban dos trayectorias de desviación diferentes. Thomson concluyó que esto era porque algunos de los iones de neón tenían diferentes masas; así fue como descubrió la existencia de los isótopos.[5]
Descubrimiento del neutrón
Véase también: Neutrón#HistoriaEn 1918, Rutherford logró partir el núcleo del átomo al bombardear gas nitrógeno con partículas alfa, y observó que el gas emitía núcleos de hidrógeno. Rutherford concluyó que los núcleos de hidrógeno procedían de los núcleos de los mismos átomos de nitrógeno.[6] Más tarde descubrió que la carga positiva de cualquier átomo equivalía siempre a un número entero de núcleos de hidrógeno. Esto, junto con el hecho de que el hidrógeno —el elemento más ligero— tenía una masa atómica de 1, le llevó a afirmar que los núcleos de hidrógeno eran partículas singulares, constituyentes básicos de todos los núcleos atómicos: se había descubierto el protón. Un experimento posterior de Rutherford mostró que la masa nuclear de la mayoría de los átomos superaba a la de los protones que tenía. Por tanto, postuló la existencia de partículas sin carga, hasta entonces desconocidas más tarde llamadas neutrones, de donde provendría este exceso de masa.
En 1928, Walther Bothe observó que el berilio emitía una radiación eléctricamente neutra cuando se le bombardeaba con partículas alfa. En 1932, James Chadwick expuso diversos elementos a esta radiación y dedujo que ésta estaba compuesta por partículas eléctricamente neutras con una masa similar la de un protón.[7] Chadwick llamó a estas partículas "neutrones".
Modelos cuánticos del átomo
El modelo planetario del átomo tenía sus defectos. En primer lugar, según la fórmula de Larmor del electromagnetismo clásico, una carga eléctrica en aceleración emite ondas electromagnéticas, y una carga en órbita iría perdiendo energía y describiría una espiral hasta acabar cayendo en el núcleo. Otro fenómeno que el modelo no explicaba era por qué los átomos excitados sólo emiten luz con ciertos espectros discretos.
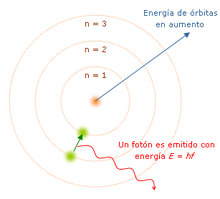
La teoría cuántica revolucionó la física de comienzos del siglo XX, cuando Max Planck y Albert Einstein postularon que se emite o absorbe una leve cantidad de energía en cantidades fijas llamadas cuantos. En 1913, Niels Bohr incorporó esta idea a su modelo atómico, en el que los electrones sólo podrían orbitar alrededor del núcleo en órbitas circulares determinadas, con una energía y un momento angular fijos, y siendo proporcionales las distancias del núcleo a los respectivos niveles de energía.[8] Según este modelo, los átomos no podrían describir espirales hacia el núcleo porque no podrían perder energía de manera continua; en cambio, sólo podrían realizar "saltos cuánticos" instantáneos entre los niveles fijos de energía.[9] Cuando esto ocurre, el átomo absorbe o emite luz a una frecuencia proporcional a la diferencia de energía (y de ahí la absorción y emisión de luz en los espectros discretos).[9] Arnold Sommerfeld amplió el átomo de Bohr en 1916 para incluir órbitas elípticas, utilizando una cuantificación de momento generalizado.
El modelo de Bohr-Sommerfeld ad hoc era muy difícil de utilizar, pero a cambio hacía increíbles predicciones de acuerdo con ciertas propiedades espectrales. Sin embargo, era incapaz de explicar los átomos multielectrónicos, predecir la tasa de transición o describir las estructuras finas e hiperfinas.
En 1924, Louis de Broglie propuso que todos los objetos —particularmente las partículas subatómicas, como los electrones— podían tener propiedades de ondas. Erwin Schrödinger, fascinado por esta idea, investigó si el movimiento de un electrón en un átomo se podría explicar mejor como onda que como partícula. La ecuación de Schrödinger, publicada en 1926,[10] describe al electrón como una función de onda en lugar de como una partícula, y predijo muchos de los fenómenos espectrales que el modelo de Bohr no podía explicar. Aunque este concepto era matemáticamente correcto, era difícil de visualizar, y tuvo sus detractores.[11] Uno de sus críticos, Max Born, dijo que la función de onda de Schrödinger no describía el electrón, pero sí a muchos de sus posibles estados, y de esta forma se podría usar para calcular la probabilidad de encontrar un electrón en cualquier posición dada alrededor del núcleo.[12]
En 1927, Werner Heisenberg indicó que, puesto que una función de onda está determinada por el tiempo y la posición, es imposible obtener simultáneamente valores precisos tanto para la posición como para el momento de la partícula para cualquier punto dado en el tiempo.[13] Este principio fue conocido como principio de incertidumbre de Heisenberg.
Los cinco orbitales atómicos de un átomo de neón, separados y ordenados en orden creciente de energía. En cada orbital caben como máximo dos electrones, que están la mayor parte del tiempo en las zonas delimitadas por las "burbujas".Este nuevo enfoque invalidaba por completo el modelo de Bohr, con sus órbitas circulares claramente definidas. El modelo moderno del átomo describe las posiciones de los electrones en un átomo en términos de probabilidades. Un electrón se puede encontrar potencialmente a cualquier distancia del núcleo, pero —dependiendo de su nivel de energía— tiende a estar con más frecuencia en ciertas regiones alrededor del núcleo que en otras; estas zonas son conocidas como orbitales atómicos.
Importancia
La importancia de esta teoría no puede ser exagerada. Se ha dicho (por ejemplo el premio Nobel Richard Feynman) que la teoría atómica es la teoría más importante en la historia de la ciencia. Esto se debe a las implicaciones que ha tenido, tanto para la ciencia básica como por las aplicaciones que se han derivado de ella.
Toda la química y bioquímica modernas se basan en la teoría de que la materia está compuesta de átomos de diferentes elementos, que no pueden transmutarse por métodos químicos. Por su parte, la química ha permitido el desarrollo de la industria farmacéutica, petroquímica, de abonos, el desarrollo de nuevos materiales, incluidos los semiconductores, y otros avances.
Véase también
Notas
- ↑ J.J. Thomson (1897), Cathode rays, Philosophical Magazine
- ↑ J.J. Thomson (Marzo de 1904), On the Structure of the Atom: an Investigation of the Stability and Periods of Oscillation of a number of Corpuscles arranged at equal intervals around the Circumference of a Circle; with Application of the Results to the Theory of Atomic Structure, Philosophical Magazine Serie 6, Vol 7, Nº 39
- ↑ H Geiger (1910), The Scattering of the α-Particles by Matter, Proceedings of the Royal Society Series A 82: 495–500
- ↑ Ernest Rutherford (1911), The Scattering of α and β Particles by Matter and the Structure of the Atom, Philosophical Magazine Serie 6, vol. 21
- ↑ J.J. Thomson (1913), Rays of positive electricity, Proceedings of the Royal Society, A 89, 1-20
- ↑ Ernest Rutherford (1919), Collisions of alpha Particles with Light Atoms. IV. An Anomalous Effect in Nitrogen., Philosophical Magazine, 6ª serie, 37, 581
- ↑ James Chadwick (27 de febrero de 1932), Possible Existence of a Neutron, Nature Magazine
- ↑ Bohr, N. (1913). On the constitution of atoms and molecules. Philosophical Magazine, 26, 1-25[1]]
- ↑ a b Bohr, N. On the constitution of atoms and molecules.
- ↑ Erwin Schrodinger (1926), Quantisation as an Eigenvalue Problem, Annalen der Physik
- ↑ Dr Subodh Mahanti, Erwin Schrodinger: The Founder of Quantum Wave Mechanics, Vigyan Prasar
- ↑ Dr Subodh Mahanti, Max Born: Founder of Lattice Dynamics, Vigyan Prasar
- ↑ ISCID, Heisenberg Uncertainty Principle
Enlaces externos
Wikimedia foundation. 2010.