- Peróxido de sodio
-
Peróxido de sodio
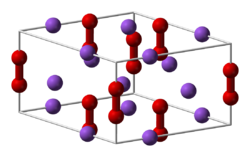
Nombre (IUPAC) sistemático Peróxido de sodio General Otros nombres Dióxido de sodio, Peróxido de disodio, Solozone™, Flocool™ Fórmula semidesarrollada Na2O2 Fórmula molecular n/d Identificadores Número CAS n/d Propiedades físicas Estado de agregación Sólido Apariencia Polvo de amarillo a blanco Densidad 2.800 kg/m3; 2.8 g/cm3 Masa molar 78 g/mol Punto de fusión 948.2 K (675 °C) Estructura cristalina Hexagonal[1] Propiedades químicas Solubilidad en agua Reacciona con agua KPS n/d Compuestos relacionados Otros aniones ? Otros cationes Peróxido de hidrógeno, Peróxido de litio, Peróxido de calcio Compuestos relacionados Peligrosidad NFPA 704 Frases R R7, R14, R26/27/28, R29, R41 Frases S S7/8, S237/38/39 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl Peróxido de sodio, Na2O2, es el producto natural de la combustión de sodio. Es un oxidante fuerte.
Contenido
Propiedades fisicoquímicas
El peróxido de sodio se hidroliza como hidróxido de sodio más peróxido de hidrógeno de acuerdo con la reacción:
- Na2O2 + 2 H2O → 2 NaOH + H2O2
El peróxido de hidrógeno formado de esta manera se decompone rápidamente (dismuta) en la solución básica resultante, produciendo agua y oxígeno. Esta reacción es marcadamente exotérmica y puede prenderle fuego a los materiales combustibles.
El Na2O2 también le prende fuego a un gran número de líquidos orgánicos al contactarlos (específicamente los alcoholes y glicoles), y produce una reacción violenta en la presencia de metales en polvo y numerosos compuestos diversos sin la necesidad de gran estímulo ninguno.
Transiciones estructurales
Tallman et al.[2] descubrieron la estructura cristalina hexagonal del peróxido de sodio. Al calentar a los 512 °C la estructura se transiciona en un paso de simetría no conocida.[3] Al sobrepasar el punto de fusión a los 675 °C, el compuesto se descompone sin capacidad en alcanzar el punto de ebullición, emitiendo O2.[4]
Preparación
El peróxido de sodio se derive directamente de una reacción de sodio con oxígeno entre los 130 y 200 °C.[3] La síntesis a temperaturas inferiores (0 - 20 °C) es posible al pasar O2 sobre una aleación de contenido metálico de sodio diluida (porcentaje molar 0.1 - 5.0). De esta manera, el sodio se oxidiza.[5] También resulta de pasar gas ozono sobre yoduro de sodio sólido dentro de un tubo de platino o paladio. El ozono oxidiza el sodio y forma el peróxido de sodio. El yodo se libera en cristales yódicos, que se puede sublimar con calor templado. El platino o paladio cataliza la reacción y no es afectado por el peróxido de sodio.
Aplicaciones
Debido a su potencial a oxidar prolíficamente, el peróxido de sodio se emplea en blanquear la pasta de madera en anticipación de producir papel. En varios puntos se ha usado para extruir los minerales de diversos menas. Se vende bajo las marcas de Solozone y Flocool. En el contexto de las investigaciones de química, el peróxido de sodio suele en tomar el papel de reactivo oxidativo; para preparación de muestras se usa en la fusión con peróxidos.
Notas
- ↑ Tallman, R. L.; Margrave, J. L.; Bailey, S. W. J. Am. Chem. Soc. 1957, 79, 2979-80. (inglés)
- ↑ Tallman, R. L.; Margrave, J. L.; Bailey, S. W. J. Am. Chem. Soc. 1957, 79, 2979-80.
- ↑ a b dic (inglés)
- ↑ Lewis, R. J. Sax's Dangerous Properties of Industrial Materials, 10th ed., John Wiley & Sons, Inc.: 2000.(inglés)
- ↑ Schechter, D. L.; Bon, C. K.; Leddy, J. J.; Process for the Preparation of Sodium Peroxide by the Oxidation of a Sodium Amalgam, U.S. Patent 3,141,736. Filed 7 May 1962. (inglés)
Categorías:- Química industrial
- Compuestos de sodio
- Peróxidos
Wikimedia foundation. 2010.