- Clorato de sodio
-
Clorato de sodio

Nombre (IUPAC) sistemático Clorato de sodio General Otros nombres Clorato sódico, clorato (V) de sodio Fórmula estructural 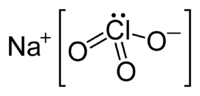
Estructura en JmolFórmula molecular NaClO3 Identificadores Número CAS 7775-09-9 PubChem ChemSpider 22895 UNII T95DR77GMR Número RTECS FO0525000 Propiedades físicas Estado de agregación Sólido Apariencia Polvo cristalino blanco, incoloro Densidad 2500 kg/m3; 2,5 g/cm3 Masa molar 106,44 g/mol Punto de fusión 521,15 K (248 °C) Punto de descomposición 573 K ( °C) Índice de refracción 1.572 Propiedades químicas Solubilidad en agua 101.0 g/100 ml (20 °C) Compuestos relacionados Otros aniones cloruro de sodio
hipoclorito de sodio
clorito de sodio
perclorato de sodioOtros cationes clorato de amonio
clorato de litio
clorato de potasio
clorato de cesioÁcido generador Ácido clórico Peligrosidad NFPA 704 Frases R R9 R22 R51/53 Frases S (S2) S13 S17 S46 S61 Número RTECS FO0525000 Riesgos Ingestión Dolor abdominal, diarrea, dificultad para respirar, vómito. Enjuagar la boca, atención médica. Inhalación Tos, dolor de garganta, azulado de piel, labios, uñas; confusión, convulsiones, mareo, dolor de cabeza, náuseas, inconciencia. Dar aire fresco, descanso, atención médica. Piel Enrojecimiento. Enjuagar con abundante agua, remover ropas contaminadas y enjuagar de nuevo, atención médica. Ojos Enrojecimiento, dolor. Enjuagar con abundante agua por varios minutos, atención médica. LD50 1200 mg/kg (ratas, oral)[1] Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl clorato de sodio es un compuesto químico con la fórmula NaClO3. Cuando está puro, es un polvo cristalino blanco que es fácilmente soluble en agua; es además higroscópico. Se descompone por arriba de 250 °C para liberar oxígeno y dejar un residuo de cloruro de sodio. A partir de septiembre de 2009, la venta al por mayor de herbicida de clorato de sodio fue prohibida en en los campos de Estados Unidos, pero se les permitió a los consumidores usar y almacenar el producto hasta el 10 de mayo de 2010.
Contenido
Síntesis
Industrialmente, el clorato de sodio es sintetizado a partir de la electrólisis de una disolución caliente de cloruro de sodio en un tanque de mezcla con electrodos:
- NaCl + 3H2O → NaClO3 + 3H2
Puede ser sintetizado también haciendo pasar cloro gaseoso a una disolución caliente de hidróxido de sodio. Es entonces purificado por cristalización.
Usos
El principal uso comercial para el clorato de sodio es para hacer dióxido de cloro, ClO2. La mayor aplicación, aproximadamente 95% del clorato, es en el blanqueado de pulpa donde el dióxido de cloro es hoy el agente blanqueador predominante.
Herbicidas
El clorato de sodio es usado como un herbicida no selectivo. Es considerado fitotóxico para todas las partes verdes de las plantas. Puede también matar a través de la absorción de las raíces.
El clorato de sodio puede ser usado para controlar:
El herbicida es usado principalmente en tierra no cultivable para el tratamiento del lugar y para el control de la vegetación total en áreas que incluyen bordes de carreteras, mallas, y zanjas.
El clorato de sodio es usado también como un defoliante y desecante para:
- Algodón,
- Cártamo,
- Maíz,
- Lino,
- Pimientos,
- Frijoles de soya,
- Granos de sorgo,
- Caupí,
- Frijoles secos,
- Arroz y
- Girasoles.
Si se usa en combinación con atrazina, se incrementa la persistencia del efecto. Si se usa en combinación con 2,4-D, mejora el rendimiento del material. El clorato de sodio tiene un efecto esterilizante del suelo. La mezcla con otros herbicidas en disolución acuosa es posible hasta cierto punto, tan pronto como no sean susceptibles a la oxidación.
Generación química de oxígeno
Los generadores químicos de oxígeno por ejemplo en vuelos comerciales proveen oxígeno de emergencia a los pasajeros para protegerlos de caídas de presión en la cabina mediante la descomposición catalítica del clorato de sodio. El catalizador es normalmente algo de polvo de hierro. El peróxido de bario (BaO2) es usado para absorber el cloro que es un producto menor en esa descomposición.[2] El polvo de hierro es mezclado con el clorato de sodio y hace ignición mediante una carga que es activada al jalar la máscara de emergencia. La reacción produce más oxígeno del que se requiere para la combustión. De forma similar, el sistema de soldadura Solidox utiliza perdigones de clorato de sodio mezclados con fibras de combustible para generar oxígeno.
Toxicidad en humanos
Debido a su naturaleza oxidante, el clorato de sodio puede ser muy tóxico si se ingiere. El efecto oxidante en la hemoglobina lleva a la formación de metahemoglobina, que es seguida por la desnaturalización de la proteína globina y una reticulación de las proteínas de las membranas de eritrocitos con un daño resultante a las enzimas de la membrana. Esto lleva a una permeabilidad incrementada de la membrana, y a una severa hemólisis. La desnaturalización de la hemoglobina excede la capacidad de la ruta metabólica de la G6PD. Además, esta enzima es directamente desnaturalizada por el clorato reduciendo su actividad.
La terapia con ácido ascórbico y azul de metileno es usada frecuentemente en el tratamiento de la metahemoglobinemia. Sin embargo, debido a que el azul de metileno requiere la presencia de NADPH que requiere del funcionamiento normal del sistema G6PD, es menos efectivo que en otras condiciones caracterizadas por la oxidación de la hemoglobina.
Resulta en hemólisis severa aguda, con falla de múltiples órganos, incluyendo CID e insuficiencia renal. Hay además una toxicidad directa al túbulo proximal renal.[3] El tratamiento consistirá de transfusión de intercambio, diálisis peritoneal o hemodiálisis.[4]
Formulaciones
El clorato de sodio viene en formulaciones en polvo, spray y gránulos. Existe riesgo de fuego y explosión en mezclas secas con otras sustancias, especialmente materiales orgánicos, como otros herbicidas, además de azufre, fósforo, metales en polvo y ácidos fuertes. Particularmente cuando se mezcla con azúcar tiene propiedades explosivas. Si es accidentalmente mezclado con una de estas sustancias no debería ser almacenado en viviendas humanas.[5]
Las formulaciones en el mercado contienen un retardador de fuego, pero esto tiene solo un pequeño efecto si es deliberadamente encendido. La mayoría de los herbicidas de clorato disponibles comercialmente contienen aproximadamente 53% de clorato de sodio con siendo el balance un depresor de fuego tal como metaborato de sodio o fosfato de amonio.
Nombres comerciales
El ingrediente activo clorato de sodio se encuentra en una variedad de herbicidas comerciales. Algunos nombres comerciales para productos que contienen clorato de sodio incluyen Atlacide, Defol, De-Fol-Ate, Drop-Leaf, Fall, Harvest-Aid, Kusatol, Leafex, y Tumbleaf. El compuesto puede ser usado en combinación con otros herbicidas tales como la atrazina, 2,4-D, bromacil, diuron, y metaborato de sodio.
El clorato de sodio fue un herbicida ampliamente usado dentro de Estados Unidos, hasta 2009 cuando fue retirado después de una decisión hecha bajo los términos de las regulaciones del país. Su uso como herbicida fuera de los EEUU permanece inalterado, y tiene uso en otras aplicaciones diferentes a esa, tales como en la producción de biocidas de dióxido de cloro y para blanqueado de pulpa y papel.
Referencias culturales
El historiador James Watson de la Universidad Massey en Nueva Zelanda escribió un artículo ampliamente reportado, The Significance of Mr. Richard Buckley's Exploding Trousers (El significado de los pantalones explosivos del Sr. Richard Buckley)[6] [7] sobre accidentes con clorato de sodio cuando son usados como un herbicida para controlar la Senecio jacobaea en los años 1930s.[8] Esto ganó después un Premio Ig Nobel en 2005,[9] y fue la base para el episodio "Pantalones explosivos" de la cuarta temporada del programa MythBusters en mayo de 2006.
Referencias
- ↑ Merck MSDS (PDF, inglés)
- ↑ Yunchang Zhang, Girish Kshirsagar, and James C. Cannon (1993). «Functions of Barium Peroxide in Sodium Chlorate Chemical Oxygen». Ind. Eng. Chem. Res. 32 (5): pp. 966–969. doi:.
- ↑ Oliver J.; MacDowell M., Tracy A (1951). «THE PATHOGENESIS OF ACUTE RENAL FAILURE ASSOCIATED WITH TRAUMATIC AND TOXIC INJURY. RENAL ISCHEMIA, NEPHROTOXIC DAMAGE AND THE ISCHEMURIC EPISODE». J Clin Invest 30 (12): pp. 1307–439. doi:. PMID 14897900.
- ↑ Goldfrank's Toxicologic Emergencies, McGraw-Hill Professional; 8th edition (March 28, 2006), ISBN 978-0-07-143763-9
- ↑ Beveridge, Alexander (1998). Forensic Investigation of Explosions. Taylor & Francis Ltd. ISBN 0-7484-0565-8.
- ↑ "The Significance of Mr. Richard Buckley's Exploding Trousers: Reflections on an Aspect of Technological Change in New Zealand Dairy Farming between the World Wars", Agricultural History magazine
- ↑ "Histories: Farmer Buckley's exploding trousers", New Scientist
- ↑ "Trousers Explode, Evening Post, 21 de abril de 1933
- ↑ James Watson for "The Significance of Mr. Richard Buckley’s Exploding Trousers.", improbable.com
Lectura adicional
- "Chlorate de potassium. Chlorate de sodium", Fiche toxicol. n° 217, Paris:Institut national de recherche et de sécurité, 2000. 4pp.
Enlaces externos
- Ficha de seguridad INSHT (PDF)
- Ficha de seguridad CDC (en inglés)
- Ficha de seguridad INCHEM (en inglés)
Categorías:- Agentes oxidantes
- Cloratos
- Compuestos de sodio
- Desecantes
- Herbicidas
Wikimedia foundation. 2010.

