- Peroxinitrito
-
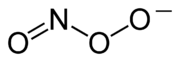
Peroxinitrito
El peroxinitrito es un anión de fórmula ONOO−. Es un isómero de valencia inestable del nitrato, NO3, el cual posee idéntica fórmula pero una estructura diferente. Aunque el ácido peroxinitroso es altamente reactivo, su base conjugada, el peroxinitrito es estable en una solución básica.[1] Es preparado por la reacción del peróxido de hidrógeno con nitrito:
- H2O2 + NO2− → ONOO− + H2O
El peroxinitrito es un agente oxidante y nitrante. Debido a sus propiedades oxidantes, el peroxinitrito puede dañar una gran variedad de moléculas en las células, incluyendo el ADN y las proteínas. La formación de peroxinitrito in vivo ha sido asociado a la reacción del radical libre superóxido con el radical libre óxido nítrico:[2]
- ·O2− + ·NO → ONO2−
El emparejamiento resultante de estos dos radicales libres resultan en peroxinitrito, una molécula que en si misma no es un radical libre, peo que es un poderoso oxidante.
En el laboratorio, una solución de peroxinitrito puede ser preparada tratando peróxido de hidrógeno acidificado con una solución de nitrito de sodio, seguida de una rápida adición de NaOH. Su concentración es indicada por la absorbancia a 302 nm (pH 12, λ302 = 1670 M−1 cm−1).[3]
Como nucleófilo
ONOO− reacciona como nucleófilo con el dióxido de carbono. In vivo, la concentración de dióxido de carbono es de aproximadamente 1 mM, y su reacción con ONOO− ocurre rápidamente. Aunque, bajo condiciones fisiológicas, la reacción de ONOO− con dióxido de carbono para formar nitrosoperoxicarbonato (ONOOCO2−) es por lejos la ruta redominante para el ONOO−. ONOOCO2− se homoliza para formar carbonato radical y dióxido de nitrógeno, de nuevo como un par de radicales. Aproximadamente el 66% del tiempo, estos dos radicales se recombinan para formar dióxido de carbono y nitrato. El restante 33% del tiempo, estos dos radicales escapan la caja de solvente y se transforman en radicales libres. Son estos dos radicales, los que se piensa que provocan daño celular relacionado a peroxinitrito.
Véase también
Referencias
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Pacher, P.; Beckman, J. S.; Liaudet, L.; “Nitric Oxide and Peroxynitrite: in Health and disease” Physiological Reviews 2007, volume 87(1), page 315-424. PMID 17237348
- ↑ Beckman, J. S.; Koppenol, W. H. “Nitric Oxide, Superoxide, and Peroxynitrite: the Good, the Bad, and Ugly” American Journal of Physiology- Cell Physiology 1996, volume 271, page C1424-C1437.
Categoría: Aniones
Wikimedia foundation. 2010.