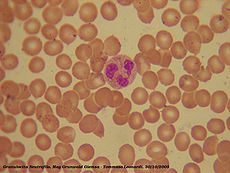
- Neutrófilo
-
Los neutrófilos, denominados también micrófagos o polimorfonucleares (PMN), son glóbulos blancos de tipo granulocito. Miden de 8.5 a 10 μm y es el tipo de leucocito más abundante de la sangre en el ser humano. Se presenta del 60 al 75%. Su periodo de vida media es corto, durando horas o algunos días. Su función principal es la fagocitosis de bacterias y hongos.[1]
Se llaman neutrófilos porque no se tiñen con colorantes ácidos ni básicos, por lo que su citoplasma se observa rosa suave. Se caracterizan por presentar un núcleo con cromatina compacta segmentada multilobulado -de 2 a 5 lóbulos conectados por delgados puentes-.[1] En neutrófilos inmaduros el núcleo se presenta sin segmentar, como una banda fuertemente teñida. Su citoplasma contiene abundantes gránulos finos color púrpura, (con el colorante Giemsa) que contienen abundantes enzimas líticas, así como una sustancia antibacteriana llamada fagocitina, todo esto necesario para la lucha contra los gérmenes extraños.
Es una célula muy móvil y su consistencia gelatinosa le facilita atravesar las paredes de los vasos sanguíneos para migrar hacia los tejidos, ayudando en la destrucción de bacterias y hongos y respondiendo a estímulos inflamatorios. A éste fenómeno se le conoce como diapédesis.
Los neutrófilos normalmente se encuentran en el torrente sanguíneo. Empero, durante el inicio agudo de la inflamación, particularmente como resultado de infección bacteriana, son unos de los primeros migrantes hacia el sitio de inflamación (primero a través de las arterias, después a través del tejido intersticial), dirigidos por señales químicas como interleucina-8 (IL-8), interferón-gamma (IFN-γ), en un proceso llamado quimiotaxis. Son las células predominantes en el pus.
La liberación de los neutrófilos desde los vasos sanguíneos está condicionada por la liberación de histamina (liberada por mastocitos) y TNF-α (liberada por macrófagos). La TNF-α y la histamina actúan sobre las células del endotelio del vaso, haciendo que se active mediante la expresión de selectina-E. Los neutrófilos activados mediante IL-8 pueden unirse a la selectina-E mediante su ligando glucídico. De esa manera son capaces de estar presentes en tejidos en apenas 5 horas después de empezar la infección. Debido a sus funciones fagocíticas, los neutrófilos también se conocen como micrófagos, para diferenciarlos de las células fagocíticas más grandes, los macrófagos.
Contenido
Diapédesis
Los neutrófilos interaccionan con agentes quimiotácticos para migrar a sitios invadidos por microorganismos, en un proceso denominado diapédesis o extravasación. Este proceso consta de tres etapas:
1. En la luz del vaso sanguíneo: marginación, rotación y adhesión al endotelio (ver también Inflamación aguda para más detalles de los pasos iniciales).
2. Migración a través de la pared del vaso sanguíneo.
3. Migración en el tejido hacia un estímulo quimiotáctico.
Adhesión al endotelio
Cuando se inicia el proceso de inflamación, se produce una vasodilatación iniciada por mediadores químicos, que provoca la salida de líquido de la sangre hacia los tejidos, generando un edema. Como consecuencia, la viscosidad de la sangre aumenta, debido al aumento de concentración de los glóbulos rojos, lo que a su vez provoca un descenso en el flujo sanguíneo (estasis). En estas condiciones hemodinámicas, los leucocitos se redistribuyen en posición periférica, un fenómeno denominado marginación. A continuación, los leucocitos ruedan sobre la superficie del endotelio, estableciendo contactos transitorios con las células endoteliales, soltándose y volviéndose a unir. Finalmente, los leucocitos se adhieren firmemente al endotelio, antes de iniciar la migración.
Simultáneamente al efecto vasodilatador, los mediadores de la inflamación (TNF e IL-1) activan las células endoteliales, que expresan proteínas de adhesión para los leucocitos. La fase de rotación está mediada por la familia de proteínas de membrana denominadas selectinas, que pueden ser de tres tipos:
- selectina-L, que se expresa en los leucocitos
- selectina-E, en las células endoteliales
- selectina-P, en las plaquetas y en las células endoteliales
Los ligandos para selectinas son oligosacáridos sialilados unidos a cadenas de glicoproteínas. La interacción entre los receptores de selectina de los neutrófilos y las selectinas de las células endoteliales da lugar a que los neutrófilos rueden con lentitud a lo largo del recubrimiento endotelial de los vasos.
Por otro lado, las quimiocinas de la inflamación provocan un cambio de estado de las integrinas de la membrana de los PMN, que pasan de una conformación de baja afinidad a una conformación de alta afinidad, mientras que la interleucina 1 (IL-1) y el factor de necrosis tumoral (TNF) inducen a las células endoteliales para que expresen moléculas de adherencia intercelular tipo 1 (ICAM-1) y VCAM-1 (vascular cell adhesion molecule-1), a las cuales se unen con avidez las moléculas de integrina de alta afinidad de los neutrófilos, provocando la adhesión firme de los PMN al endotelio.
Migración a través del endotelio
Es el fenómeno denominado diapédesis o extravasación, y ocurre fundamentalmente en las vénulas poscapilares. Las quimioquinas liberadas por los macrófagos y los mastocitos tisulares en respuesta a la presencia de microorganismos, cuerpos extraños o daño tisular, actúan sobre los PMN adheridos al endotelio, estimulando su migración a través de los espacios interendoteliales hacia el sitio dañado o infectado. Algunas moléculas presentes en las uniones entre las células endoteliales facilitan la migración de los neutrófilos, como CD31 o PECAM-1, proteínas de la familia de las inmunoglobulinas. Después de atravesar el endotelio, los PMN deben romper la lámina basal, probablemente segregando colagenasas, y entrar en el tejido extravascular. Para ello, los leucocitos se adhieren a la matriz extracelular mediante la unión de sus integrinas y CD44 a las proteínas de la matriz.
Quimiotaxis de los leucocitos
Una vez en el compartimiento de tejido conectivo, los leucocitos migran hacia la zona dañada por un proceso denominado quimiotaxis, que se define como la locomoción dirigida a lo largo de un gradiente químico. Las sustancias que generan dicho gradiente pueden ser exógenas (por ejemplo, toxinas bacterianas) o endógenas, entre las que se encuentran diferentes mediadores químicos:
- citoquinas, sobre todo las de la familia de las quimioquinas (como IL-8);
- componentes del sistema del complemento, sobre todo C5a;
- metabolitos del ácido araquidónico, sobre todo el leucotrieno B4 (LTB4).
Todos estos agentes se unen a receptores transmembrana acoplados a proteína G en la superficie de los leucocitos. Esto desencadena una vía de señalización que resulta en la activación de segundos mensajeros que aumentan el calcio citosólico y activan GTPasas y kinasas. Como consecuencia, se induce la polimerización de la actina, que genera un aumento de actina polimerizada en el extremo celular próximo a la región dañada, y localización de los filamentos de miosina en la parte posterior celular. El leucocito se mueve extendiendo filopodios que tiran de la parte posterior celular en dirección de la extensión, como un coche con tracción delantera. El resultado final es que el leucocito se mueve hacia la zona objetivo.
Reconocimiento de los microbios y los tejidos muertos
Una vez que se encuentran en la zona objetivo, los neutrófilos deben reconocer de forma específica el agente ofensivo, antes de proceder a eliminarlo. Tanto los neutrófilos como los macrófagos (las células con capacidad fagocítica) presentan receptores de membrana que les permite reconocer el agente externo y activar los procesos de fagocitosis. Los tipos de receptores más importantes son:
Receptores para componentes microbianos
Los receptores de tipo Toll (TLR, por sus siglas en inglés) reconocen componentes de diferentes tipos de microbios: lipopolisacáridos bacterianos, proteoglicanos bacterianos, nucleótidos CpG no metilados (frecuentes en bacterias) o ARN de doble hebra (producido por algunos virus). Los TLR están presentes en la superficie celular, pero también en los endosomas, de manera que pueden detectar microbios extracelulares y fagocitados. Estos receptores activan kinasas que estimulan la producción de sustancias microbicidas.
Receptores acoplados a proteínas G
Algunos de estos receptores reconocen péptidos que contengan fragmentos de N-formilmetionina (que inician todas las proteínas bacterianas, pero sólo están presentes en las proteínas mitocondriales de mamíferos). Otros receptores reconocen quimioquinas, fragmentos del sistema del complemento, como C5a, y mediadores lipídicos, como PAF, prostaglandinas o leucotrienos, todos los cuales se producen en el contexto de daño celular. Unión del ligando a estos receptores induce la migración y la produción de sustancias microbicidas.
Receptores para opsoninas
Los leucocitos expresan receptores para opsoninas, proteínas de defensa que recubren los microbios mediante el proceso de opsonización. Estas sustancias incluyen anticuerpos, proteínas del sistema del complemento y lectinas. Una de las formas más eficaces de mejorar la fagocitosis de una partícula es recubrirla con anticuerpos tipo IgG específicas para esa partícula. Los IgG son reconocidos por los receptores de alta afinidad para Fcγ de los fagocitos, denominados FcγR. Asimismo, C3b (del sistema del complemento) es también una potente opsonina, y los fagocitos expresan un receptor, CR1, capaz de detectarlo. La unión de las opsoninas a sus receptores en los fagocitos promueven la fagocitosis y activan los leucocitos.
Receptores para citoquinas
Los leucocitos tienen receptores para citoquinas que son producidas en presencia de microbios. La más importante de éstas citoquinas es el interferón-γ (IFN-γ), segregado por las células NK activadas por microbios y por linfocitos T activados por antígenos durante la respuesta inmune adaptativa. El IFN-γ es el principal agente activador de los macrófagos.
Eliminación del agente dañino: fagocitosis
La unión de los ligandos a los receptores de los leucocitos induce su activación, debido a la iniciación de vías de señalización que producen un aumento de los niveles de calcio citosólicos y la activación de enzimas como PKC y fosfolipasa A2. La respuesta funcional más importante es la fagocitosis y la destrucción intracelular del agente dañino.
La fagocitosis se desarrolla en tres etapas secuenciales:
Reconocimiento y unión
Mediado por los receptores de manosa y receptores a diferentes opsoninas presentes en el agente dañino. El receptor de manosa es una lectina que se une a los residuos de manosa y fucosa de las glicoproteínas y los glicolípidos. Estos residuos son típicos de las paredes bacterianas, mientras que las glicoproteínas y glicolípidos de mamíferos contienen residuos terminales de ácido siálico. Por tanto, los receptores de manosa se unen de forma específica a moléculas bacterianas.
Incorporación en la vacuola fagocítica
Una vez que la partícula está unida a los receptores, se forman extensiones del citoplasma (pseudópodo) que la rodean, la membrana plasmática se fusiona y se forma una vesícula (el fagosoma) que contiene la partícula. El fagosoma se fusiona entonces con un lisosoma, que descarga su contenido en el fagolisosoma. Durante este proceso el fagocito puede también liberar el contenido de los lisosomas al espacio extracelular, sobre todo si la partícula que se pretende fagocitar es demasiado grande para ser incorporada en una vesícula.
La fagocitosis (que es un proceso muy complejo) depende de la polimerización de actina, por lo que las mismas señales que activan la quimiotaxis activan también la fagocitosis.
Destrucción del material ingerido
Los neutrófilos contienen dos tipos de gránulos:
- los gránulos específicos (o secundarios), más grandes, que contienen lisozima, colagenasa, gelatinasa, lactoferrina, activador del plasminógeno, histaminasa y fosfatasa alcalina;
- los gránulos azurófilos (o primarios) contienen mieloperoxidasa, factores bactericidas (lisozima, defensinas), hidrolasas ácidas y una variedad de proteasas neutras (elastasa, catepsina G y otras).
Ambos tipos de gránulos pueden fusionarse con las vacuolas fagocíticas que contienen el material ingerido, vertiendo su contenido para digerirlo.
Las bacterias no sólo se destruyen por la acción de enzimas sino también y sobre todo por la formación de especies reactivas del oxígeno (ROS) y especies reactivas del nitrógeno (NOS) dentro de los fagosomas de los neutrófilos. Algunos de estos compuestos son:
- aniones superóxidos (02~), que se forman por acción de la oxidasa de NADPH (también llamada fagocito oxidasa) sobre el O2 en una reacción oxidativa muy rápida que se denomina estallido respiratorio;
- el peróxido de hidrógeno (H2O2), formado por la acción de la superóxido dismutasa sobre el anión superóxido;
- hipoclorito (OCl*, el ingrediente activo de la lejía), formado por la acción de la mieloperoxidasa (MPO) sobre el peróxido de hidrógeno en presencia de iones cloruro; el sistema H2O2-MPO-Cloruro es el microbicida más eficaz de los neutrófilos;
- la sintasa de óxido nítrico genera NO a partir de arginina; el NO también tiene efectos microbicidas;
- el NO puede reaccionar con el anión superóxido para generar el radical peroxinitrito (ONOO*), altamente reactivo.
Todos estos radicales libres del oxígeno y del nitrógeno atacan y dañan los lípidos, proteínas y ácidos nucleicos de los microbios, así como del huésped.
En ocasiones se libera el contenido de los gránulos azurófilos a la matriz extracelular y causa daño tisular, pero por lo general la catalasa y la glutatión peroxidasa degradan el peróxido de hidrógeno. Sin embargo, los leucocitos pueden causar daños importantes en las células normales y los tejidos en algunas circunstancias:
- en infecciones difíciles de erradicar, como la tuberculosis y ciertas enfermedades virales, la respuesta prolongada del huésped contribuye más a la patología que el microbio en sí mismo, ya que los tejidos adyacentes a la infección sufren daños colaterales de larga duración;
- cuando la respuesta inflamatoria se dirige de forma inapropiada hacia los tejidos del huésped, como en ciertas enfermedades autoinmunes;
- cuando el huésped reacciona de forma exagerada a sustancias ambientales normalmente inocuas, en enfermedades alérgicas como el asma.
En estos casos, los leucocitos dañan los tejidos sanos con los mismos mecanismos que atacan los microbios, ya que una vez que son activados, no distinguen entre huésped y patógeno. Las enzimas y las especies reactivas de oxígeno y nitrógeno liberadas al espacio intracelular pueden dañar los tejidos sanos y el endotelio, amplificando la acción del patógeno. De hecho, en estos casos los leucocitos en sí mismos constituyen la amenaza mayor, y subyacen como la causa principal de las alteraciones presentes en muchas enfermedades humanas:
- agudas: asma, rechazo agudo a un trasplante, síndrome respiratorio agudo severo, glomerulonefritis, choque séptico o absceso pulmonar;
- crónicas: artritis, asma, aterosclerosis, rechazo crónico a un trasplante, fibrosis pulmonar, obesidad.
Los neutrófilos tienen una vida media corta y mueren por apoptosis unas pocas horas después de dejar la sangre, una vez que han llevado a cabo su función de destruir microorganismos. Ello tiene como efecto la formación de pus, en el que se produce la acumulación de leucocitos (sobre todo neutrófilos) y bacterias muertos y líquido extracelular.
Los neutrófilos también están siendo objeto de debate en las terapias contra el cáncer. Si bien ciertos estudios sugieren su posible participación en la angiogénesis y la metástasis, otros los consideran elementos indispensables en la batalla contra los tumores sólidos, como en la controvertida teoría desarrollada por el equipo multidisciplinar que dirige el físico e investigador Antonio Brú.
Bibliografía
- Robbins and Cotran Pathologic Basis of Disease, 8th edición, Saunders (Elsevier) «Ch.2 Acute and chronic inflammation», (2009).
Referencias
- ↑ a b [http://www.anatomohistologia.uns.edu.ar/plantilla.asp?zona=modhemat Sangre y gematopoyesis, por G.Gigola, Anatomo-Histología - Universidad Nacinal del Sur
Categoría:- Leucocitos
Wikimedia foundation. 2010.