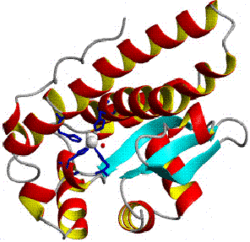
- Superóxido dismutasa
-
Superóxido dismutasa 1, soluble HUGO 11179 Símbolo SOD1 Símbolos alt. ALS, ALS1 Datos genéticos Locus Cr. 21 q22.1 Bases de datos Número EC 1.15.1.1 Entrez 6647 OMIM 147450 RefSeq NM_000454 UniProt P00441 Superóxido dismutasa 2, mitocondrial HUGO 11180 Símbolo SOD2 Datos genéticos Locus Cr. 6 q25 Bases de datos Número EC 1.15.1.1 Entrez 6648 OMIM 147460 RefSeq NM_000636 UniProt P04179 Superóxido dismutasa 3, extracelular HUGO 11181 Símbolo SOD3 Datos genéticos Locus Cr. 4 pter-q21 Bases de datos Número EC 1.15.1.1 Entrez 6649 OMIM 185490 RefSeq NM_003102 UniProt P08294 La enzima superóxido dismutasa (SOD) cataliza la dismutación de superóxido en oxígeno y peróxido de hidrógeno. Debido a esto es una importante defensa antioxidante en la mayoría de las células expuestas al oxígeno. Una de las excepciones se da en Lactobacillus plantarum y en lactobacilli relacionados que poseen un mecanismo diferente.
Contenido
Reacción
La dismutación catalizada por SOD del superóxido puede representarse como las siguientes semireacciones:
- M(n+1)+ − SOD + O2− → Mn+ − SOD + O2
- Mn+ − SOD + O2− + 2H+ → M(n+1)+ − SOD + H2O2.
donde M = Cu (n=1) ; Mn (n=2) ; Fe (n=2) ; Ni (n=2).
En esta reacción el estado de oxidación del catión metálico oscila entre n y n+1.
Tipos
General
Existen varias formas comunes de SOD: son proteínas con cofactores como cobre, zinc, manganeso, hierro o níquel.
- El citosol de prácticamente todas las células eucariotas contiene una enzima SOD con cobre y zinc (Cu-Zn-SOD). (Por ejemplo, la Cu-Zn-SOD disponible comercialmente es purificada normalmente de eritrocitos de bovinos: PDB 1SXA, EC 1.15.1.1). La enzima de Cu-Zn es un homodímero de peso molecular 32,5 kDa. Las dos subunidades están unidas por interacciones hidrofóbicas y electrostáticas. Los ligandos de cobre y zinc son cadenas laterales de histidina.
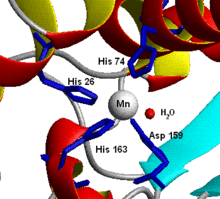
- Mitocondrias de hígado de pollo (y casi todos los demás) y muchas bacterias (e.g. E. coli) contienen una forma con manganeso (Mn-SOD). (Por ejemplo la Mn-SOD que se encuentra en las mitocondrias humanas: PDB 1N0J, EC 1.15.1.1). Los ligandos de los iones de manganeso son tres cadenas laterales de histidina, una de aspartato y una molécula de agua o un ligando hidroxilo dependiendo del estado de oxidación del Mn (II y III respectivamente).
- E. coli y muchas otras bacterias contienen una forma de la enzima con hierro (Fe-SOD); algunas bacterias contienen Fe-SOD, otras Mn-SOD, y algunas contienen ambas. (Para la E. coli Fe-SOD: PDB 1ISA, EC 1.15.1.1). Los sitios activos de las superóxido dismutasas de Mn y Fe contienen el mismo tipo de cadenas laterales de aminoácidos.
Hombre
En humanos existen tres formas de superóxido dismutasa. SOD1 se encuentra en el citoplasma, SOD2 en las mitocondrias y SOD3 en el líquido extracelular. La primera es un dímero (consiste en dos subunidades), mientras que las otras son tetrámeros (cuatro subunidades). SOD1 y SOD3 contienen cobre y zinc, mientras que SOD2 tiene manganeso en su centro reactivo. Los genes se encuentran localizados en los cromosomas 21, 6 y 4, respectivamente (21q22.1, 6q25.3 y 4p15.3-p15.1).
Hay disponibles placas para ensayos de microtitulación de SOD.[1]
Bioquímica
La SOD protege a la célula de las reacciones dañinas del superóxido. La reacción de superóxido con especies no radicales no es permitida por spin según las reglas de selección. En sistemas biológicos esto significa que sus principales reacciones son con sí mismo (dismutación) o con otro radical biológico como el óxido nítrico (NO). El anión radical de superóxido (O2-) espontáneamente dismuta a O2 y peróxido de hidrógeno (H2O2) de forma bastante rápida (~105 M-1 s-1 a pH 7). SOD es biológicamente necesaria porque el superóxido reacciona aún más rápido con algunos blancos como el radical de NO, que forma peroxinitrito. De forma similar, la tasa de dismutación es de segundo orden con respecto a la concentración inicial de superóxido. Aunque la vida media del superóxido es muy corta en concentraciones muy elevadas (e.g. 0,05 segundos a 0,1mM) es bastante larga en bajas concentraciones (e.g. 14 horas a 0,1 nM). En contraste, la reacción de superóxido con SOD es de primer orden con respecto a la concentración de superóxido. Además, la SOD tiene el mayor número de recambio (tasa de reacción con su sustrato) de ninguna enzima conocida (~109 M-1 s-1), esta reacción está solamente limitada por la frecuencia de colisiones de la enzima con el superóxido. Es decir, la tasa de reacción está limitada por la difusión.
Fisiología
Superóxido es una de las principales especies reactivas del oxígeno en la célula y la SOD tiene un papel fundamental como antioxidante. La importancia fisiológica de la SOD es ilustrada por las severas patologías que se evidencian en ratones genéticamente modificados para que carezcan de esta enzima. Los ratones sin SOD2 mueren a los pocos días de nacer por estrés oxidativo masivo.[2] Los ratones sin SOD1 desarrollan una gran variedad de patologías, incluyendo hepatocarcinoma,[3] una acelerada pérdida de masa muscular relacionada con la edad,[4] una temprana incidencia de cataratas y una esperanza de vida reducida. Los ratones carentes de SOD3 no muestran deficiencias obvias y tienen una esperanza de vida normal.[5]
Papel en las enfermedades
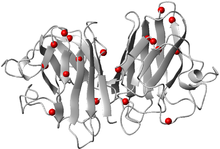 Localización de algunas de las mutaciones de la SOD1 relacionadas con la esclerosis lateral amiotrófica según Banci et al, 2008.[6]
Localización de algunas de las mutaciones de la SOD1 relacionadas con la esclerosis lateral amiotrófica según Banci et al, 2008.[6]
A fecha de mayo de 2010 se han encontrado 248 mutaciones en las SOD.[7] De ellas, Las mutaciones en la primera enzima SOD (SOD1) se han relacionado con la esclerosis lateral amiotrófica (ELA). Las otras dos tipos de enzimas no se han relacionado con ninguna patología conocida, sin embargo en ratones la inactivación de SOD2 provoca la muerte perinatal[2] e inactivación de SOD1 causa hepatocarcinoma.[3] Las mutaciones en SOD1 pueden provocar ELA a través de un mecanismo que aún no es comprendido, pero que no se debe a una pérdida de la actividad enzimática. La sobreexpresión de SOD1 se ha relacionado con el síndrome de Down.[8] El medicamento "Orgotein" contiene superóxido dismutasa purificada de hígado bovino.
Uso en cosméticos
La SOD es usada en productos cosméticos para reducir el daño de los radicales libres a la piel, por ejemplo para reducir la fibrosis que se produce como consecuencia de la radioterapia. Estos estudios deben ser considerados como tentativos ya que no han habido controles adecuados en los estudios, incluyendo la falta de ensayos de aleatoriedad, doble ciego o placebo.[9] Se sabe que la superóxido dismutasa revierte la fibrosis,[10] posiblemente a través de la reversión de los miofibroblastos de nuevo a fibroblastos
Véase también
Referencias
- ↑ A.V. Peskin, C.C. Winterbourn (2000). «A microtiter plate assay for superoxide dismutase using a water-soluble tetrazolium salt (WST-1)». Clinica Chimica Acta 293: pp. 157–166.
- ↑ a b Li, et al., Y. (1995). «Dilated cardiomyopathy and neonatal lethality in mutant mice lacking manganese superoxide dismutase.». Nat. Genet. 11: pp. 376-381.
- ↑ a b Elchuri, et al., S. (2005). «CuZnSOD deficiency leads to persistent and widespread oxidative damage and hepatocarcinogenesis later in life.». Oncogene 24: pp. 367-380.
- ↑ Muller, et al., F. L. (2006). «Absence of CuZn superoxide dismutase leads to elevated oxidative stress and acceleration of age-dependent skeletal muscle atrophy.». Free Radic. Biol. Med 40: pp. 1993-2004.
- ↑ Sentman, et al., M. L. (2006). «Phenotypes of mice lacking extracellular superoxide dismutase and copper- and zinc-containing superoxide dismutase». J. Biol. Chem. 281: pp. 6904-6909. doi:.
- ↑ «SOD1 and Amyotrophic Lateral Sclerosis: Mutations and Oligomerization». PLoS ONE 3 (2). 2008. doi:. http://www.plosone.org/article/info:doi%2F10.1371%2Fjournal.pone.0001677.
- ↑ «All of the mutations in alsod. (248)». Consultado el 18 de mayo de 2010.
- ↑ Groner, Y. et al. (1994). «Cell damage by excess CuZnSOD and Down's syndrome.». Biomed Pharmacother. 48: pp. 231-40. PMID 7999984.
- ↑ Campana, F. (2004). «Topical superoxide dismutase reduces post-irradiation breast cancer fibrosis». J. Cell. Mol. Med. 8 (1): pp. 109–116. PMID 15090266. http://www.jcmm.org/en/pdf/8/1/jcmm008.001.11.pdf.
- ↑ Vozenin-Brotons, MC. et al. (2001). «Antifibrotic action of Cu/Zn SOD is mediated by TGF-beta1 repression and phenotypic reversion of myofibroblasts.». Free Radic Biol Med. 30 (1): pp. 30–42. PMID 11134893. http://www.ncbi.nlm.nih.gov/sites/entrez?cmd=Retrieve&db=PubMed&list_uids=11134893&dopt=Abstract.
Enlaces externos
- OMIM 105400 (ELA)
- Resumen general de SOD y su literatura.
- Damage-Based Theories of Aging Incluye una discusión de los roles de SOD1 y SOD2 en el envejecimiento.
- SOD and Oxidative Stress Pathway Image
- Historical information on SOD research"The evolution of Free Radical Biology & Medicine: A 20-year history" y "Free Radical Biology & Medicine The last 20 years: The most highly cited papers"
- JM McCord discute el descubrimiento de SOD
Categorías:- Genes del cromosoma 21
- Genes del cromosoma 6
- Genes del cromosoma 4
- Transducción de señales
- Antioxidantes
- Oxidorreductasas
- Compuestos organometálicos
Wikimedia foundation. 2010.