- Estrés oxidativo
-
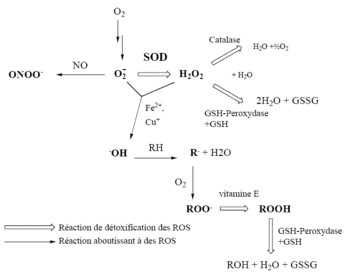
Las especies reactivas del oxígeno y su sistema de detoxificación (versión simplificada). SOD : superóxido dismutasa, GSH-peroxidasa : glutatión peroxidasa. Si este sistema es desbordado, surge una situación de estrés oxidativo.

El estrés oxidativo es causado por un desequilibrio entre la producción de especies reactivas del oxígeno y la capacidad de un sistema biológico de detoxificar rápidamente los reactivos intermedios o reparar el daño resultante. Todas las formas de vida mantienen un entorno reductor dentro de sus células. Este entorno reductor es preservado por las enzimas que mantienen el estado reducido a través de un constante aporte de energía metabólica. Desbalances en este estado normal redox pueden causar efectos tóxicos a través de la producción de peróxidos y radicales libres que dañan a todos los componentes de la célula, incluyendo las proteínas, los lípidos y el ADN.
En el ser humano, el estrés oxidativo está involucrado en muchas enfermedades, como la aterosclerosis, la enfermedad de Parkinson, encefalopatía miálgica, sensibilidad química múltiple, y la enfermedad de Alzheimer y también puede ser importante en el envejecimiento. Sin embargo, las especies reactivas de oxígeno pueden resultar beneficiosas ya que son utilizadas por el sistema inmunitario como un medio para atacar y matar a los patógenos. Las especies reactivas del oxígeno son también utilizadas en la señalización celular. Esta es denominada señalización redox.
Contenido
Efectos químicos y biológicos
En términos químicos, el estrés oxidativo es un gran aumento (cada vez más negativo) en la reducción del potencial celular o una gran disminución en la capacidad reductora de los pares redox celulares como el glutatión.[1] Los efectos del estrés oxidativo dependen de la magnitud de estos cambios, si la célula es capaz de superar las pequeñas perturbaciones y de recuperar su estado original. Sin embargo, el estrés oxidativo severo puede causar la muerte celular y aún una oxidación moderada puede desencadenar la apoptosis, mientras que si es muy intensa puede provocar la necrosis.[2]
Un aspecto particularmente destructivo del estrés oxidativo es la producción de especies de oxígeno reactivo, que incluyen los radicales libres y los peróxidos. Algunas de las menos reactivas de estas especies (como el superóxido) pueden ser convertidas por una reacción redox con metales de transición u otros compuestos de ciclo redox en quinonas, especie radical más agresiva que puede causar extenso daño celular.[3] La mayoría de estas especies derivadas del oxígeno se producen en un nivel bajo en condiciones normales de metabolismo aeróbico y el daño que causan a las células es reparado constantemente. Sin embargo, bajo los graves niveles de estrés oxidativo que causa la necrosis, el daño produce agotamiento de ATP impidiendo la muerte celular por apoptosis controlada, provocando que la célula simplemente se desmorone.[4] [5]
Oxidante Descripción •O2-, Anión superóxido Estado de reducción de un electrón de O2, formado en muchas reacciones de autooxidación y por la cadena de transporte de electrones. Es poco reactivo, pero puede liberar Fe2+ de proteínas ferrosulfuradas y de la ferritina. Sufre dismutación para formar H2O2 espontáneamente o por catálisis enzimática y es un precursor para la formación de • OH catalizado por metales. H2O2, peróxido de hidrógeno Estado de reducción de dos electrones, formado por la dismutación de •O2- o por reducción directa de O2. Soluble en lípidos y por ende capaz de difundir por membranas. •OH, radical hidroxilo Estado de reducción de tres electrones, formado por la reacción de Fenton y la descomposición de peroxinitrito. Extremadamente reactivo, ataca la mayoría de los componentes celulares. ROOH, hidroperóxido orgánico Formado por reacciones de radicales con componentes celulares como lípidos y nucleobases. RO•, alcoxi- y ROO•, peroxi- Radicales orgánicos centrados en oxígeno. Formas lipídicas participan en reacciones de peroxidación de lípidos. Producido en presencia de oxígeno por adición de radicales a dobles enlaces o eliminación de hidrógeno. HOCl, ácido hipocloroso Formado a partir de H2O2 por la mieloperoxidasa. Soluble en lípidos y altamente reactivo. Rápidamente oxida constituyentes de proteínas, incluyendo grupos tiol, grupos amino y metionina. OONO-, peroxinitrito Formado en una rápida reacción entre •O2- y NO•. Liposoluble y similar en reactividad al ácido hipocloroso. Protonación forma ácido peroxinitroso, que puede someterse a escisión homolítica para formar radicales de hidroxilo y de dióxido de nitrógeno. Producción y consumo de oxidantes
La fuente más importante de oxígeno reactivo en condiciones normales en organismos aeróbicos es probablemente la pérdida de oxígeno activado de las mitocondrias durante el funcionamiento normal de la respiración oxidativa.
Otros enzimas capaces de producir superóxido son la xantina oxidasa, NADPH oxidasa y citocromo P450. El peróxido de hidrógeno es producido por una amplia variedad de enzimas incluidas monooxigenasas y oxidasas. Las especies reactivas de oxígeno juegan un papel muy importante en la señalización celular, en un proceso denominado señalización redox. Así, para mantener la homeostasis celular, debe lograrse un equilibrio entre la producción de oxígeno reactivo y su consumo.
Los antioxidantes celulares mejor estudiados son las enzimas superóxido dismutasa (SOD), catalasa y glutatión peroxidasa. Antioxidantes enzimáticos menos estudiados (pero probablemente muy importantes) son la peroxirredoxina y la sulfirredoxina. Otros enzimas que tienen propiedades antioxidantes (aunque esta no es su función primordial) incluyen la paraoxonasa, la glutatión S-transferasa, y la aldehído deshidrogenasa.
El estrés oxidativo contribuye a la lesión tisular después de la irradiación e hiporexia. Se sospecha (aunque no está demostrado) que es importante en las enfermedades neurodegenerativas incluida la enfermedad de Lou Gehrig, la enfermedad de Parkinson, la enfermedad de Alzheimer y la enfermedad de Huntington. También se considera que está vinculado a ciertas enfermedades cardiovasculares, ya que la oxidación de LDL en el endotelio vascular es un precursor de la formación de placas. Además desempeña un papel en la cascada isquémica debido a los daños por la reperfusión de oxígeno que sigue a la hipoxia. Esta cascada incluye tanto los accidentes cerebrovasculares como ataques cardíacos.
Antioxidantes como suplementos
El uso de antioxidantes para prevenir enfermedades es controvertido.[9] En un grupo de alto riesgo como los fumadores, altas dosis de beta-caroteno aumentan la tasa de cáncer de pulmón.[10] En grupos de bajo riesgo, el uso de la vitamina E parece reducir el riesgo de enfermedades cardíacas.[11] En otras enfermedades, como la enfermedad de Alzheimer, las pruebas sobre la suplementación con vitamina E arrojan resultados mixtos.[12] [13] Sin embargo, la nitrona eliminadora de radicales de AstraZeneca, la droga NXY-059 muestra alguna eficacia en el tratamiento de accidentes cerebrovasculares.[14]
El estrés oxidativo (tal como Denham Harman lo formuló en su teoría de los radicales libres) se cree que también contribuye al proceso de envejecimiento. Aunque hay pruebas favorables que confirman esta idea en organismos modelo como Drosophila melanogaster y Caenorhabditis elegans[15] [16] las pruebas en mamíferos son menos claras.[17] [18] [19]
Catalizadores metálicos
Metales tales como hierro, cobre, cromo, vanadio y cobalto son capaces de hacer ciclos redox en los que un solo electrón puede ser aceptado o donado por el metal. Esta acción cataliza reacciones que producen radicales y puede producir especies reactivas del oxígeno. Las reacciones más importantes son probablemente la reacción de Fenton y la reacción de Haber-Weiss, en el que se producen radicales hidroxilo de la reducción del hierro y peróxido de hidrógeno. Los radicales hidroxilo pueden dar lugar a modificaciones de los aminoácidos (e.g. la formación de meta-tirosina y orto-tirosina a partir de fenilalanina), hidratos de carbono, iniciar la peroxidación de lípidos, y oxidar nucleobases. La mayoría de las enzimas que producen las especies reactivas del oxígeno contienen uno de estos metales. La presencia de estos metales en los sistemas biológicos de forma no complejada (no en una proteína u otro tipo de protección del complejo metálico) puede aumentar significativamente el nivel de estrés oxidativo. En el ser humano la hemocromatosis se asocia con un aumento de los niveles de hierro tisular, la enfermedad de Wilson con un aumento de los niveles de cobre en los tejidos y el manganesismo con la exposición crónica a los minerales de manganeso.
Catalizadores redox no metálicos
Determinados compuestos orgánicos, además de catalizadores redox metálicos también pueden producir especies reactivas del oxígeno. Una de las más importantes son las quinonas. Las quinonas puede hacer un ciclo redox con sus conjugados semiquinonas e hidroquinonas, en algunos casos, catalizando la producción de superóxido desde peróxido de hidrógeno. El estrés oxidativo generado por el agente reductor ácido úrico puede estar implicado en el síndrome de Lesch-Nyhan, accidentes cerebrovasculares y el síndrome metabólico. Del mismo modo la producción de especies reactivas del oxígeno en presencia de homocisteína en homocisteinuria, así como arteriosclerosis, accidentes cerebrovasculares, y Alzheimer.
Defensa inmune
El sistema inmunitario utiliza los letales efectos de los oxidantes haciendo de las especies oxidantes una parte central de su mecanismo para matar a los agentes patógenos; con la producción de los fagocitos activados de ERO y las especies reactivas del nitrógeno. Estos incluyen el superóxido (•O2-), el óxido nítrico (•NO), y en particular su producto reactivo, peroxinitrito (OONO-).[20] Aunque el uso de estos compuestos altamente reactivos en la respuesta citotóxica de los fagocitos causa daños a los tejidos huésped, la no especificidad de estos oxidantes es una ventaja, ya que pueden dañar casi cualquier parte de la célula blanco.[8] Esto impide que un agente patógeno escape de esta parte de la respuesta inmunitaria mediante la mutación de un único blanco molecular.
Referencias
- ↑ Schafer F, Buettner G (2001). «Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione couple». Free Radic Biol Med 30 (11): pp. 1191-212. PMID 11368918.
- ↑ Lennon S, Martin S, Cotter T (1991). «Dose-dependent induction of apoptosis in human tumour cell lines by widely diverging stimuli». Cell Prolif 24 (2): pp. 203-14. PMID 2009322.
- ↑ Valko M, Morris H, Cronin M (2005). «Metals, toxicity and oxidative stress». Curr Med Chem 12 (10): pp. 1161-208. PMID 15892631.
- ↑ Lelli J, Becks L, Dabrowska M, Hinshaw D (1998). «ATP converts necrosis to apoptosis in oxidant-injured endothelial cells». Free Radic Biol Med 25 (6): pp. 694-702. PMID 9801070.
- ↑ Lee Y, Shacter E (1999). «Oxidative stress inhibits apoptosis in human lymphoma cells». J Biol Chem 274 (28): pp. 19792-8. PMID 10391922.
- ↑ Sies, H. Oxidative stress: introductory remarks. In Oxidative Stress, H. Sies, (Ed.) London: Academic Press Inc,(1985) pp. 1-7.
- ↑ Docampo, R. . Antioxidant mechanisms. In Biochemistry and Molecular Biology of Parasites, J. Marr and M. Müller, (Eds.) London: Academic Press, (1995) pp. 147-160
- ↑ a b Rice-Evans C, Gopinathan V. «Oxygen toxicity, free radicals and antioxidants in human disease: biochemical implications in atherosclerosis and the problems of premature neonates». Essays Biochem 29: pp. 39-63. PMID 9189713.
- ↑ Meyers D, Maloley P, Weeks D (1996). «Safety of antioxidant vitamins». Arch Intern Med 156 (9): pp. 925-35. PMID 8624173.
- ↑ Ruano-Ravina A, Figueiras A, Freire-Garabal M, Barros-Dios J (2006). «Antioxidant vitamins and risk of lung cancer». Curr Pharm Des 12 (5): pp. 599-613. PMID 16472151.
- ↑ Pryor W (2000). «Vitamin E and heart disease: basic science to clinical intervention trials». Free Radic Biol Med 28 (1): pp. 141-64. PMID 10656300.
- ↑ Boothby L, Doering P (2005). «Vitamin C and vitamin E for Alzheimer's disease». Ann Pharmacother 39 (12): pp. 2073-80. PMID 16227450.
- ↑ Kontush K, Schekatolina S (2004). «Vitamin E in neurodegenerative disorders: Alzheimer's disease». Ann N Y Acad Sci 1031: pp. 249-62. PMID 15753151.
- ↑ Fong J, Rhoney D (2006). «NXY-059: review of neuroprotective potential for acute stroke». Ann Pharmacother 40 (3): pp. 461-71. PMID 16507608.
- ↑ Larsen P (1993). «Aging and resistance to oxidative damage in Caenorhabditis elegans». Proc Natl Acad Sci U S A 90 (19): pp. 8905-9. PMID 8415630. http://www.ncbi.nlm.nih.gov/entrez/utils/fref.fcgi?itool=AbstractPlus-def&PrId=3494&uid=8415630&db=pubmed&url=http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=8415630.
- ↑ Helfand S, Rogina B. «Genetics of aging in the fruit fly, Drosophila melanogaster». Annu Rev Genet 37: pp. 329-48. PMID 14616064.
- ↑ Sohal R, Mockett R, Orr W (2002). «Mechanisms of aging: an appraisal of the oxidative stress hypothesis». Free Radic Biol Med 33 (5): pp. 575-86. PMID 12208343.
- ↑ Sohal R (2002). «Role of oxidative stress and protein oxidation in the aging process». Free Radic Biol Med 33 (1): pp. 37-44. PMID 12086680.
- ↑ Rattan S (2006). «Theories of biological aging: genes, proteins, and free radicals». Free Radic Res 40 (12): pp. 1230-8. PMID 17090411.
- ↑ Nathan C, Shiloh M (2000). «Reactive oxygen and nitrogen intermediates in the relationship between mammalian hosts and microbial pathogens». Proc Natl Acad Sci U S A 97 (16): pp. 8841-8. PMID 10922044. http://www.pubmedcentral.nih.gov/picrender.fcgi?artid=34021&blobtype=pdf.
- Current Medicinal Chemistry, Volume 12, Number 10, May 2005, pp. 1161-1208(48) Metals, Toxicity and Oxidative Stress
- Strand, What Your Doctor Doesn't Know about Nutritional Medicine May Be Killing You.
- Parker, The Antioxidant Miracle.
Categoría:- Fisiología celular
Wikimedia foundation. 2010.