- Plutonio
-
Plutonio
Neptunio - Plutonio - Americio Sm
Pu
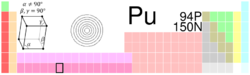
General Nombre, símbolo, número Plutonio, Pu, 94 Serie química Actínidos Grupo, periodo, bloque n/a, 7, f Densidad 19.816 Apariencia Blanco plateado

Propiedades atómicas Masa atómica 244 u Radio atómico 175 pm Radio de Van der Waals ? Configuración electrónica [Rn] 5f6 7s2 Estados de oxidación (óxido) 6, 5, 4, 3 (óxido anfotérico) Estructura cristalina Monoclínica Propiedades físicas Estado de la materia Sólido Punto de fusión 912,5 K Punto de ebullición 3.501 K Entalpía de vaporización 333,5 kJ/mol Entalpía de fusión 2,82 kJ/mol Presión de vapor 10,00 Pa a 2.926 K Velocidad del sonido 2.260 m/s a 293,15 K Información diversa Electronegatividad 1,28(Pauling) Calor específico 35,5 J/(kg·K) Resistencia eléctrica 0,685 m-1·Ω-1 Conductividad térmica 6,74 W/(m·K) 1er potencial de ionización 584,7 kJ/mol Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
†Calculado a partir de distintas longitudes
de enlace covalente, metálico o iónico.Plutonio, de símbolo Pu, es un elemento metálico radiactivo que se utiliza en reactores y armas nucleares. Su número atómico es 94. Es uno de los elementos transuránicos del grupo de los actínidos del sistema periódico. Su nombre deriva del dios romano de los infiernos, Plutón (mitología).
Los isótopos del plutonio fueron preparados y estudiados por vez primera por el químico estadounidense Glenn T. Seaborg y sus colegas de la Universidad de California en Berkeley, en 1940. Se han encontrado cantidades menores del elemento en las minas de uranio, pero en la actualidad se preparan cantidades relativamente grandes de plutonio en los reactores nucleares.
Químicamente, el plutonio es reactivo, y sus propiedades se asemejan a las de los lantánidos. El metal plateado, que se vuelve ligeramente amarillo con la oxidación causada por la exposición al aire, existe en seis formas cristalinas y tiene cuatro estados de oxidación diferentes. El metal desprende calor debido a su radiactividad.
Se conocen 15 isótopos diferentes del plutonio, con números másicos entre 232 y 246; el plutonio 244 es el más estable. El isótopo de número másico 239 tiene un periodo de semidesintegración de 24.360 años y se produce bombardeando uranio 238 con neutrones lentos; esto forma neptunio 239, que a su vez emite una partícula beta formando plutonio 239. El plutonio es el elemento transuránico más importante económicamente porque el plutonio 239 admite fácilmente la fisión y puede ser utilizado y producido en grandes cantidades en los reactores nucleares. Es un veneno extremadamente peligroso debido a su alta radiactividad.
Véase también
- Energía nuclear
- Efectos biológicos de la radiación
- Energías renovables
- Abandono de la energía nuclear
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Plutonio.Commons
Wikimedia Commons alberga contenido multimedia sobre Plutonio.Commons- ATSDR en Español - ToxFAQs™: Plutonio (Pu) Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
- ATSDR en Español - Resumen de Salud Pública: Plutonio (Pu) Departamento de Salud y Servicios Humanos de EE. UU. (dominio público)
Categorías: Elementos químicos | Actínidos | Carcinógenos | Materiales nucleares
Wikimedia foundation. 2010.
