- Propiedad coligativa
-
Propiedad coligativa
En química, se llaman propiedades coligativas aquellas propiedades de una solución que dependen únicamente de la concentración molal, es decir, de la cantidad de partículas de soluto por partículas totales, y no de la naturaleza o tipo de soluto. Están estrechamente relacionadas con la presión de vapor, que es la presión que ejerce la fase de vapor sobre la fase líquida, cuando el líquido se encuentra en un recipiente cerrado.
La presión de vapor depende del solvente y de la temperatura a la cual sea medida (a mayor temperatura, mayor presión de vapor). Se mide cuando el sistema llega al equilibrio dinámico, es decir, cuando la cantidad de moléculas de vapor que vuelven a la fase líquida es igual a las moléculas que se transforman en vapor.
Contenido
Propiedades coligativas más comunes
Descenso de la presión de vapor
Véase también: Presión de vaporCuando se prepara una solución con un disolvente puro y un soluto no volátil (que se transformará en gas) y se mide su presión, al compararla con la presión de vapor de su solvente puro (medidas a la misma temperatura) se observa que la de la solución es menor que la del solvente. Esto es consecuencia de la presencia del soluto no volátil.
A su vez, cuando se comparan las presiones de vapor de dos soluciones de igual composición y diferente concentración, aquella solución más concentrada tiene menor presión de vapor. El descenso de ésta se produce por dos razones: por probabilidad, pues es menos probable que existan moléculas de disolvente en el límite de cambio, y por cohesión, pues las moléculas de soluto atraen a las de disolvente por lo que cuesta más el cambio.
Descenso crioscópico
El soluto obstaculiza la formación de cristales sólidos, por ejemplo el líquido refrigerante de los motores de los automóviles tiene una base de agua pura a presión atmosférica se congelaría a 0°C dentro de las tuberías y no resultaría útil en lugares fríos. Para evitarlo se le agregan ciertas sustancias químicas que hacen descender su punto de congelación.
-
- ΔTf = Kf · m
- m es la molalidad. Se expresa en moles de soluto por kilogramo de disolvente (mol/kg).
- ΔTf es el descenso del punto de congelación y es igual a Tf - T donde T es el punto de congelación de la solución y Tf es el punto de congelación del disolvente puro.
- Kf es una constante de congelación del disolvente. Su valor, cuando el solvente es agua es 1,86 ºC kg/mol
Aplicación
Para enfriar algo rápidamente se hace una mezcla de hielo con sal o, si tiene precaución, alcohol. El punto de congelación bajará y el hielo se derretirá rápidamente. Pese a aparentar haberse perdido el frío, la mezcla formada estará en realidad a unos cuantos grados bajo cero y será mucho más efectiva para enfriar que los cubos de hielo sólidos. Es una consecuencia del descenso de la presión de vapor.
El punto de congelación es la temperatura a la cual un líquido comienza a congelarse (transformarse en sólido). Su valor coincide con el punto de fusión (cambio opuesto, pero en lugar de entregar energía para congelarse, el sistema recibe energía para fundirse y volverse líquido). Para una solución se confirma que su punto de congelación es menor que el de su solvente puro. Por ejemplo, el agua se congela a partir de los 0°C, mientras que una solución formada por agua y sal se congelará a menor temperatura (de ahí que se utilice sal para fundir nieve).
Aumento ebulloscópico
Al agregar moléculas o iones a un solvente puro la temperatura en el que éste entra en ebullición es más alto. Por ejemplo, el agua pura a presión atmosférica ebulle a 100°, pero si se disuelve algo en ella el punto de ebullición sube algunos grados centígrados.
-
- ΔTb = Kb · m
- m es la molalidad. Se expresa en moles de soluto por kilogramo de disolvente (mol/kg).
- ΔTb es el aumento del punto de ebullición y es igual a T - Tb donde T es el punto de ebullición de la solución y Tb el del disolvente puro.
- Kb es una constante de ebullición del disolvente. Su valor cuando el solvente es agua es 0,52 ºC kg/mol.
Aplicación
Cuando un mol de una sal se disuelve en solución, el efecto del aumento del punto de ebullición es aún mayor, pues la sal hará un efecto tal que será el total de las partes que se disuelven. Por ejemplo, el NaCl será disuelto en un mol de sodio y un mol de cloro, un total de dos moles en solución.
El punto de ebullición es la temperatura a la cual la presión de vapor de un solvente o solución iguala la presión externa y comienza a observarse las moléculas de líquido transformarse en gas. Por ejemplo, a presión externa de 1 atm, el agua hierve a 100°C, mientras que para una solución acuosa de algo a 100°C las presiones externas y de vapor no se han igualado y por ende no se observa el cambio a estado gaseoso. Cuando la presión de vapor iguale la presión externa la temperatura de la solución será mayor que 100°C y, consecuentemente, se comprueba que su punto de ebullición es, efectivamente, mayor que el punto de ebullición de su solvente puro (agua) medido a una misma presión externa.
Presión osmótica
La ósmosis es la tendencia que tienen los solventes a ir desde zonas de mayor hacia zonas de menor concentración de partículas. El efecto puede pensarse como una tendencia de los solventes a "diluir". Es el pasaje espontáneo de solvente desde una solución más diluida hacia una solución más concentrada, cuando se hallan separadas por una membrana semipermeable
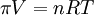 (también: π = (nRT) / V)
(también: π = (nRT) / V)- n es el número de moles de partículas en la solución.
- R es la constante universal de los gases, donde R = 8.314472 J · K-1 · mol-1.
- T es la temperatura en grados kelvin.
Teniendo en cuenta que n/V representa la molaridad (M) de la solución obtenemos:
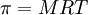
Al igual que en la ley de los gases ideales, la presión osmótica no depende de la carga de las partículas.
Aplicación
El experimento más típico para observar el fenómeno de ósmosis es el siguiente:
- Se colocan dos soluciones con distinta concentración (por ejemplo, una consta de agua con sal común o azúcar y la otra de agua sola).
- Ambas soluciones se ponen en contacto a través de una membrana semipermeable que permite el movimiento del agua a través de ella, es decir, que permite que el solvente pase y las partículas no. El papel celofán suele funcionar, pero debe ser verdadero papel celofán y no sus sustitutos.
- Al cabo de un tiempo se podrá observar que el solvente ha pasado de la solución diluida hacia la solución concentrada y los niveles de líquido han cambiado.
Las membranas celulares son semipermeables. La observación al microscopio de células que previamente han estado sumergidas en soluciones de sal común o azúcar, permite constatar el efecto de la entrada de agua (turgencia) o la pérdida de agua (plasmólisis) en función de que el medio exterior sea hipertónico o hipotónico respecto al medio interno celular.
Véase también
- Ascenso ebulloscópico.
- Descenso crioscópico.
Enlaces externos
Categoría: Propiedades químicas -
Wikimedia foundation. 2010.
