- Reacción de Baylis-Hillman
-
Reacción de Baylis-Hillman
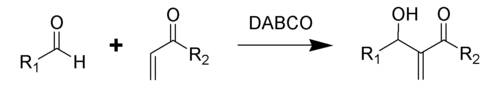
La reacción de Baylis-Hillman es una reacción orgánica de un aldehído y un compuesto orgánico insaturado con un grupo atractor de electrones, catalizada por DABCO (1,4-diazabiciclo[2.2.2]octano) para producir un alcohol alílico.[1] Esta reacción es conocida también como la reacción de Morita-Baylis-Hillman o reacción MBH.[2] Debe su nombre al químico japonés Ken-ichi Morita, el químico inglés Anthony B. Baylis y el químico alemán Melville E. D. Hillman.
Además del DABCO, se ha encontrado que otras aminas nucleófilas, como el DMAP y DBU, así como fosfinas, catalizan exitosamente esta reacción.
Mecanismo de reacción
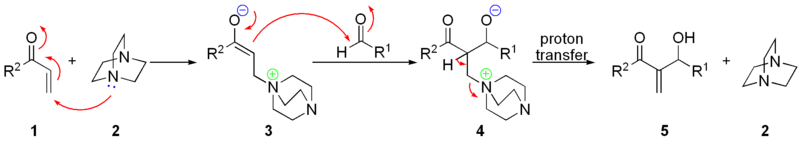
La adición nucleofílica de DABCO 2 a la cetona α,β-insaturada 1 produce un intermediario zwitterion 3, que se adicionará al aldehído electrófilo, produciendo el ceto-alcohol 4. La eliminación del DABCO conduce al alcohol alílico deseado 5.
Existe una relación simple entre el pKa de la base (como su ácido conjugado) y la velocidad de reacción con la quinuclidina, aún más efectiva que con el DABCO. Los aditivos próticos como el metanol, trietanolamina, formamida y el agua también aceleran la reacción.[3]
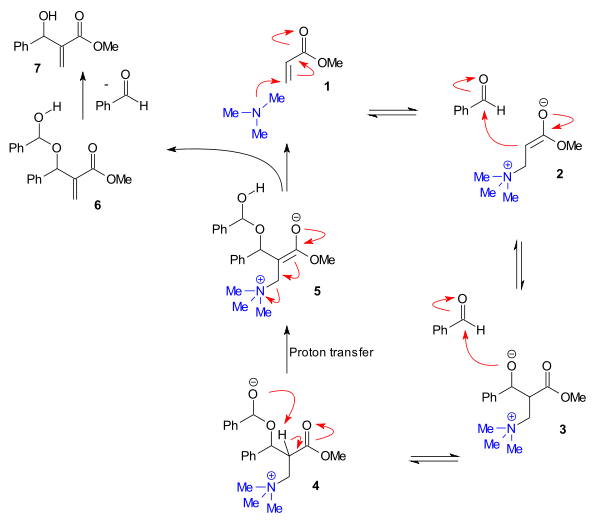
Un mecanismo alterno, basado en bastante información de velocidades, se ha propuesto para algunos aldehídos.[4] [5] [6] Este mecanismo toma en cuenta la cinética de segundo orden determinada experimentalmente para el aldehído, y un efecto cinético isotópico sustancial para el hidrógeno alfa de la enona. En él, una segunda molécula de aldehído reacciona para formar un hemiacetal (4) y este paso es seguido por la etapa determinante de la reacción: la transferencia del protón al intermediario 5.
Experimentos in silico confirman este mecanismo[7] y también explican cómo los aditivos próticos incrementan la velocidad de reacción al facilitar el paso de transferencia del protón. Algunos de los intermediarios clave también pueden ser detectados experimentalmente por ESI-MS[8]
Una reacción relacionada que precede a la reacción de Baylis-Hillman, utilizando fosfinas y no DABCO, es la reacción de Rauhut-Currier.
Limitaciones
La reacción MBH de la fenil vinil cetona con el benzaldehído y el DABCO en DMF no está limitada al monoaducto, porque el aducto MBH reacciona con una segunda molécula de fenil vinil cetona en una adición nucleofílica conjugada.[9]
Referencias
- ↑ Baylis, A. B.; Hillman, M. E. D. German Patent 2155113, 1972.
- ↑ K. Morita, Z. Suzuki and H. Hirose, Bull. Chem. Soc. Jpn.,1968, 41, 2815.
- ↑ Correlation between pKa and Reactivity of Quinuclidine-Based Catalysts in the Baylis-Hillman Reaction: Discovery of Quinuclidine as Optimum Catalyst Leading to Substantial Enhancement of Scope Aggarwal, V. K.; Emme, I.; Fulford, S. Y. J. Org. Chem. (Article); 2003; 68(3); 692-700. DOI 10.1021/jo026671s
- ↑ Baylis-Hillman Mechanism: A New Interpretation in Aprotic Solvents Price, K. E.; Broadwater, S. J.; Jung, H. M.; McQuade, D. T.; Org. Lett., 2005, 7(1), 147-150. DOI 10.1021/ol047739o
- ↑ A New Interpretation of the Baylis-Hillman Mechanism Price, K. E.; Broadwater, S. J.; Walker, B. J.; McQuade, D. T. J. Org. Chem. (Article); 2005; 70(10); 3980-3987. DOI 10.1021/jo050202j
- ↑ Synthetic potential of the tertiary-amine-catalysed reaction of activated vinyl carbanions with aldehydes Drewes, S. E.; Roos, G. H. P.; Tetrahedron 1988, 44, 4653-4670. DOI 10.1016/S0040-4020(01)86168-8
- ↑ Mechanism of the Morita-Baylis-Hillman Reaction: A Computational Investigation Raphael Robiette, Varinder K Aggarwal, and Jeremy N. Harvey J. AM. CHEM. SOC. 2007, 129, 15513-15525 DOI 10.1021/ja0717865
- ↑ Dualistic Nature of the Mechanism of the Morita-Baylis-Hillman Reaction Probed by Electrospray Ionization Mass Spectrometry Giovanni W. Amarante, Humberto M. S. Milagre, Boniek G. Vaz, Bruno R. Vilacha Ferreira, Marcos N. Eberlin, and Fernando Coelho J. Org. Chem., 2009, 74 (8), 3031-3037 DOI 10.1021/jo802578t
- ↑ Different Reaction Patterns in the Baylis-Hillman Reaction of Aryl Aldehydes with Phenyl Vinyl Ketone, Phenyl Acrylate and Phenyl Thioacrylate Min Shi, Chao-Qun Li and Jian-Kang Jiang Molecules 2002, 7, 721-733 Full Article
Categoría: Reacciones químicas orgánicas
Wikimedia foundation. 2010.