- Acetilserotonina O-metiltransferasa
-
acetilserotonina O-metiltransferasa HUGO 750 Símbolo ASMT Símbolos alt. HIOMT Datos genéticos Locus Cr. X p22.3 Bases de datos Número EC 2.1.1.4 Entrez 438 OMIM 402500 RefSeq NM_004043 UniProt P46597 Acetilserotonina O-metiltransferasa Identificadores Número EC 2.1.1.4 Bases de datos IntEnz IntEnz view BRENDA BRENDA entry ExPASy NiceZyme view KEGG KEGG entry MetaCyc metabolic pathway PRIAM profile PDB structures Buscar PMC articles PubMed articles N-Acetilserotonina O-metiltransferasa (ASMT) también conocida como hidroxindol O-metiltransferasa (HIOMT) es una enzima que cataliza la reacción final de la síntesis de melatonina. Esta reacción se incluye en las rutas metabólicas del triptófano.
Contenido
Reacción catalizada
Esta enzima metila el grupo hidroxilo en posición 5 del anillo indólico de la N-acetilserotonina utilizando como donador de grupos metilo la S-Adenosil metionina.[1]
S-Adenosil metionina +
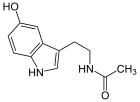 → S-Adenosil L-homocisteína +
→ S-Adenosil L-homocisteína + 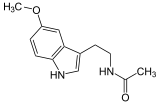
Esta enzima puede actuar sobre otros hidroxindoles como ácido 5-hidroxindolacético dando lugar al ácido 5-metoxindolacético [2]
S-Adenosil metionina +
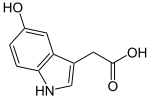 → S-Adenosil L-homocisteína +
→ S-Adenosil L-homocisteína + 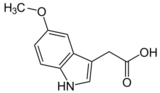
Estructura y localización génica
En humanos, la enzima ASMT (HIOMT) está codificada por el gen ASMT situado en la región pseudoautosómica de los cromosomas sexuales. Hay un alelo en el cromosoma X y el otro en el cromosoma Y.[3] [4]
La actividad enzimática ASMT se encuentra en niveles elevados en la glándula pineal y en la retina en la especie humana[5] y en la mayoría de los vertebrados.
Sinónimos
Nombre sistemático: S-adenosil-L-metionina:N-acetilserotonina O-metiltransferasa
Otros sinónimos son (por orden de frecuencia de uso): Hidroxindol O-metiltransferasa (HIOMT), Acetilserotonina O-metiltransferasa (ASMT), Acetilserotonina metiltransferasa (cromosoma Y).
Organismos
N-Acetilserotonina O-metiltransferasa se encuentra en procariotas, como las bacterias Rhodopirellula baltica y Chromobacterium violaceum y en eucariotas como Gallus gallus (pollos), Bos taurus (vacas), Homo sapiens (humanos), Macaca mulatta (macacos rhesus), y Rattus norvegicus (ratas)
Ejemplos de secuencias de Aminoácidos
Bos taurus (350 Aminoácidos)
MCSQEGEGYSLLKEYANAFMVSQVLFAACELGVFELLAEALEPLDSAAVSSHLGSSPGD RAATEHLCVPEAAASRREGRKSCVCKHGARQHLPGERQPQVPAGHAAVRGQDRLRLLAP PGEAVREGRNQYLKAFGIPSEELFSAIYRSEDERLQFMQGLQDVWRLEGATVLAAFDLS PFPLICDLGGGSGALAKACVSLYPGCRAIVFDIPGVVQIAKRHFSASEDERISFHEGDF FKDALPEADLYILARVLHDWTDAKCSHLLQRVYRACRTGGGILVIESLLDTDGRGPLTT LLYSLNMLVQTEGRERTPGRSTARSVGPAASETCGDGGRGEPTMLSWPGNQACSV
Homo sapiens (373 Aminoácidos)
MGSSEDQAYRLLNDYANGFMVSQVLFAACELGVFDLLAEAPGPLDVAAVAAGVRASAHG TELLLDICVSLKLLKVETRGGKAFYRNTELSSDYLTTVSPTSQCSMLKYMGRTSYRCWG HLADAVREGRNQYLETFGVPAEELFTAIYRSEGERLQFMQALQEVWSVNGRSVLTAFDL SVFPLMCDLGGTRIKLETIILSKLSQGQKTKHRVFSLIGGAGALAKECMSLYPGCKITV FDIPEVVWTAKQHFSFQEEEQIDFQEGDFFKDPLPEADLYILARVLHDWADGKCSHLLE RIYHTCKPGGGILVIESLLDEDRRGPLLTQLYSLNMLVQTEGQERTPTHYHMLLSSAGF RDFQFKKTGAIYDAILARK
Splicing alternativo
El gen HIOMT en la especie humana tiene una longitud aproximada de 35 kb y está formado por 9-10 exones. El gen puede sufrir un splicing alternativo dando lugar al menos a tres posibles isoformas proteicas, aunque parece ser que todas las isoformas tienen la misma capacidad de sintetizar melatonina. También se han encontrado múltiples regiones promotoras, indicando la posible existencia de varios mecanismos de regulación de su expresión.[4]
Expresión en células inmunes
Estudios recientes han encontrado transcritos de ARNm del gen HIOMT en linfocitos B, linfocitos T CD4+, linfocitos T citotóxicos, y linfocitos NK en humanos. Este hallazgo junto con la investigación sobre las variantes de splicing de la HIOMT, sugiere que la HIOMT juega un papel importante en el sistema inmune humano, además de su papel en el sistema endocrino y nervioso.[6]
Implicaciones clínicas
Tumores
Existen evidencias experimentales de una elevada expresión del gen de la HIOMT en tumores parenquimales de la glándula pineal. Este hecho ha dirigido el estudio de la expresión de este gen como marcador diagnóstico de este tipo de tumor. Niveles anormalmente elevados de HIOMT en la glándula pineal puede servir como indicador de la existencia de este tipo de tumores cerebrales.[7]
Desórdenes psiquiátricos
Los niveles de melatonina se usan como marcador de desórdenes psiquiátricos, en conjunción con otros criterios de diagnóstico para determinar la existencia de numerosos desórdenes como por ejemplo Trastorno afectivo estacional, Trastorno bipolar, o Trastorno depresivo. Los niveles de melatonina también dan idea sobre la severidad de la enfermedad del paciente en un momento dado.[8]
Análisis de ligamiento
Véase también
- metiltransferasa
Referencias
- ↑ Caspi R, Foerster H, Fulcher CA, Hopkinson R, Ingraham J, Kaipa P, Krummenacker M, Paley S, Pick J, Rhee SY, Tissier C, Zhang P, Karp PD (January 2006). «MetaCyc: a multiorganism database of metabolic pathways and enzymes». Nucleic Acids Res. 34 (Database issue): pp. D511–6. doi:. PMID 16381923. PMC 1347490. http://www.ai.sri.com/pkarp/pubs/06metacyc.pdf.
- ↑ Kanehisa, M., Goto, S., Hattori, M., Aoki-Kinoshita, K.F., Itoh, M., Kawashima, S., Katayama, T., Araki, M., and Hirakawa, M.; From genomics to chemical genomics: new developments in KEGG. Nucleic Acids Res. 34, D354-357 (2006). [pubmed] [pdf] [Véase los comentarios en la web del autor Thomson]
- ↑ Donohue SJ, Roseboom PH, Illnerova H, Weller JL, Klein DC (October 1993). «Human hydroxyindole-O-methyltransferase: presence of LINE-1 fragment in a cDNA clone and pineal mRNA». DNA Cell Biol. 12 (8): pp. 715–27. PMID 8397829.
- ↑ a b Rodriguez IR, Mazuruk K, Schoen TJ, Chader GJ (December 1994). «Structural analysis of the human hydroxyindole-O-methyltransferase gene. Presence of two distinct promoters». J. Biol. Chem. 269 (50): pp. 31969–77. PMID 7989373. http://www.jbc.org/cgi/content/abstract/269/50/31969.
- ↑ OMIM 300015
- ↑ Pozo D, García-Mauriño S, Guerrero JM, Calvo JR (August 2004). «mRNA expression of nuclear receptor RZR/RORalpha, melatonin membrane receptor MT, and hydroxindole-O-methyltransferase in different populations of human immune cells». J. Pineal Res. 37 (1): pp. 48–54. doi:. PMID 15230868.
- ↑ Fèvre-Montange M, Champier J, Szathmari A, Wierinckx A, Mottolese C, Guyotat J, Figarella-Branger D, Jouvet A, Lachuer J (July 2006). «Microarray analysis reveals differential gene expression patterns in tumors of the pineal region». J. Neuropathol. Exp. Neurol. 65 (7): pp. 675–84. doi:. PMID 16825954.
- ↑ Srinivasan V, Smits M, Spence W, Lowe AD, Kayumov L, Pandi-Perumal SR, Parry B, Cardinali DP (2006). «Melatonin in mood disorders». World J. Biol. Psychiatry 7 (3): pp. 138–51. doi:. PMID 16861139.
Enlaces externos
Categorías:- Genes del cromosoma X
- Bioquímica
- Enzimas
- Transferasas
Wikimedia foundation. 2010.
