- Citrato sintasa
-
Citrato sintas 
Citrato sintasaHUGO 2422 Símbolo CS Datos genéticos Código de gen CS Tipo de gen Gen Codificante Locus Cr. 12 q13.2 Estructura/Función proteica Tamaño 466 (aminoácidos) Bases de datos Número EC 2.3.3.1 Entrez 1431 OMIM 118950 RefSeq NM_004077 UniProt O75390 La citrato sintasa (CS) (EC 2.3.3.1) es una enzima que existe en casi todas las células y cataliza la primera reacción del ciclo de Krebs. En las células eucariotas la citrato sintasa se localiza en la matriz mitocondrial, pero es condificada por ADN nuclear en vez de por ADN mitocondrial. Es sintetizada por ribosomas citoplasmáticos y entonces transportada a la matriz mitocondrial. La citrato sintasa se utiliza comunmente como marcador enzimático cuantitativo para la presencia de mitocondrias intactas.
La citrato sintasa cataliza la reacción de condensación del acetato, proveniente del acetil-CoA, y del oxaloacetato para formar citrato. El oxaloacetato es regenerado después de completar el ciclo de Krebs.
- Acetil-CoA + Oxaloacetato + H2O
 Citrato + CoA-SH
Citrato + CoA-SH
El oxaloacetato es el primer sustrato que se une a la enzima. Este induce a la enzima a cambiar su conformación y crea un sitio de unión para el acetil-CoA. Cuando el citroil-CoA se ha formado, la enzima sufre otro cambio conformacional que causa la hidrólisis del tioéster liberando coenzima A. Esto asegura que la energía liberada por la rotura del enlace tioéster conduce la reacción.
Contenido
Estructura
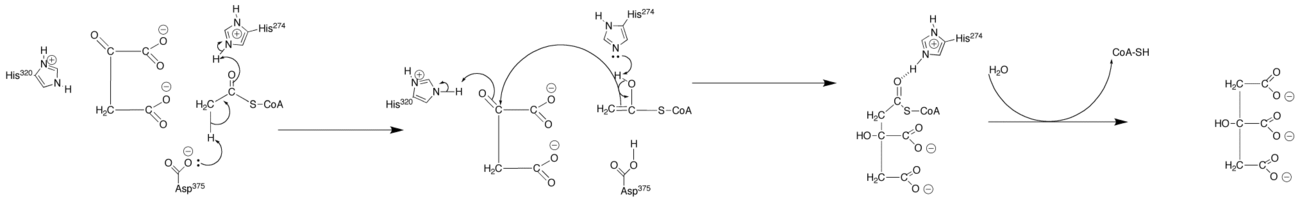
La citrato sintasa se presenta como un homodímero. Cada subunidad consiste de unas 20 hélices alfa. Estas hélices alfa comprenden aproximadamente el 75% de la estructura terciaria de la citrato sintasa, mientras que los residuos restantes componen principalmente extensiones irregulares de la estructura, a excepción de una lámina beta de unos 13 aminoácidos. Entre las subunidades existe un único hueco que contiene el sitio activo. Se encuentran también dos sitios de unión: uno reservado para el citrato u oxaloacetato, y otro reservado para la coenzima A. El sitio activo contiene tres residuos claves: His-274, His-320 y Asp-375, que son altamente selectivos en sus interacciones con los sustratos.
Mecanismo
La citrato sintasa tiene tres aminoácidos clave en su sitio activo que catalizan la conversión del acetil-CoA y del oxaloacetato a citrato en una reacción de condensación aldólica.
- La conversión comienza con el oxígeno cargado negativamente situado en el grupo R del Asp-375 deprotonando el carbono alfa del acetil-CoA. Esto empuja al electrón para formar un doble enlace con el carbono carbonilo, que fuerza al C=O a desplazar un protón para el oxígeno desde uno de los nitrógenos del grupo R de la His-274. Esto neutraliza el grupo R (formando un par solitario en el nitrógeno) y completa la formación de un intermedio enol (CH2COH-SCoA).
- En este momento, el par solitario de la His-274, formado en la última etapa ataca al protón que fue añadido al oxígeno. El oxígeno, entonces, reforma el enlace carbonilo que libera el C=C e inicia el ataque nucleofílico al carbono carbonilo del oxaloacetato. Esto libera la mitad del enlace carbonilo para deprotonar uno de los grupos amino de la His-320, que neutraliza uno de los nitrógenos de su grupo R. Esta adición nucleofílica resulta en la formación de citroil-CoA.
- En este momento, una molécula de agua es deprotonada por el grupo amino de la His-320 y se inicia la hidrólisis. Uno de los pares solitarios del oxígeno ataca nucleófilicamente el carbono carbonilo del citroil-CoA. Esto forma un intermedio tetraédrico y resulta en la eyección de -SCoA. El -SCoA es protonado para formar HSCoA. Finalmente, el hidroxilo añadido al carbonilo es deprotonado y se forma citrato.
Inhibición
La enzima es inhibida por ratios altos de ATP/ADP, acetil-CoA/CoA y NADH/NAD, ya que las altas concentraciones de ATP, acetil-CoA y NADH muestran que el suministro energético es alto para la célula. La citrato sintasa también es inhibida por el succinil-CoA y el citrato (inhibición por producto).
La inhibición de la citrato sintasa por análogos del acetil-CoA ha sido bien documentada y ha sido usada para probar la existencia de un único sitio activo. Estos experimentos han revelado que este único sitio alterna entre dos formas con actividad ligasa e hidrolasa.
Estereoespecificidad
En la naturaleza existen dos enzimas citrato sintasa con estereoespecificidades contrarias:
- Citrato (Si)-sintasa (EC 2.3.3.1). La enzima habitual en los seres vivos.
- Citrato (Re)-sintasa (EC 2.3.3.3). Encontrada en algunos organismos anaerobios (clostridium acidi-urici, clostridium cylindrosporum, clostridium kluyveri, desulfovibrio desulfuricans, desulfovibrio vulgaris). Esta enzima es desactivada por el oxígeno.
Enlaces externos
- Acetil-CoA + Oxaloacetato + H2O
Wikimedia foundation. 2010.