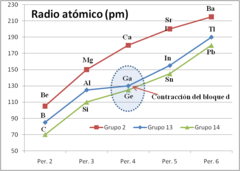
- Contracción del bloque d
-
La contracción del bloque d (a veces llamada contracción escándida) es un término usado en química para describir el efecto de que los Elementos del periodo 4 que tienen el orbital d lleno poseen un tamaño menor que los elementos del bloque d del mismo periodo de la tabla periódica. Los elementos en cuestión son Ga, Ge, As, Se y Br. Sus configuraciones electrónicas poseen el orbital d completamente lleno (d10). La contracción del bloque d se ilustra mejor mediante la comparación de algunas propiedades de los elementos del grupo 13 para poner de relieve el efecto sobre el galio.
Contenido
El caso del galio
Se ilustra especialmente bien en el caso del galio, cuyo tamaño es más pequeño de lo que debería, si se le compara con el tamaño del aluminio.[1]
Elemento Configuración electrónica
del átomoSuma del 1er al 3er
Potenc. de Ioniz. (kJ/mol)Configuración electrónica
del ion M3+Radio del ion M3+ (pm) Boro, B {He}2s22p1 6887,4 {He} Aluminio, Al {Ne}3s23p1 5139 {Ne} 53,5 Galio, Ga {Ar}3d104s24p1 5521,1 {Ar}3d10 62 Indio, In {Kr}4d105s25p1 5083 {Kr} 4d10 80 Talio, Tl {Xe}4f145d106s26p1 5438,4 {Xe}5d10 88,5 El galio puede ser considerado anómalo. El efecto más obvio es que la suma de los tres primeros potenciales de ionización del galio es superior a esa misma suma para el aluminio, mientras que la tendencia en el grupo sería que fuese más baja. En la segunda tabla se muestra la evolución de la suma de los tres primeros potenciales de ionización de los elementos B, Al, Sc, Y , La. Los elementos Sc, Y, y La son [[elementos del grupo 3]] de la tabla periódica y tienen tres electrones de valencia por encima de una configuración electrónica de gas noble. En contraste con los elementos del grupo 13, esta secuencia muestra una reducción suave.
Elemento Configuración electrónica
del átomoSuma del 1er al 3er
Potenc. de Ioniz. (kJ/mol)Configuración electrónica
del ion M3+Radio del ion M3+ (pm) Boro, B {He}2s22p1 6887,4 {He} Aluminio, Al {Ne}3s23p1 5139 {Ne} 53,5 Escandio, Sc {Ar}3d14s2 4256,7 {Ar} 74,5 Itrio, Y {Kr}4d15s2 3760 {Kr} 90 Lantano, La {Xe}5d16s2 3455,4 {Xe} 103,2 Otros efectos de la contracción del bloque d son que el ion Ga3+ es de menor tamaño que lo esperado, al estar más cerca en tamaño a Al3+. Se debe tener cuidado en la interpretación de los potenciales de ionización para el indio y el talio, pues otros efectos como por ejemplo, el efecto del par inerte son cada vez más importantes para los miembros más pesado del grupo.
La causa de la contracción del bloque d son el pobre apantallamiento de la carga nuclear por parte de los electrones en los orbitales d. Los electrones de valencia exteriores están más fuertemente atraídos por el núcleo lo que provoca el incremento observado en los potenciales de ionización. La contracción del bloque d se puede comparar con la contracción lantánida o contracción del bloque f, que es causada por el inadecuado apantallamiento de la carga nuclear por los electrones que ocupan orbitales f.El radio de los metales de transición
Este efecto también describe la tendencia en el radio atómico que experimentan los elementos del bloque d (metales de transición). Normalmente, la tendencia del radio atómico, al avanzar por un periodo de la tabla periódica, es que disminuye de manera significativa. En los metales de transición con electrones d, cuando nos movemos de izquierda a derecha en la tabla periódica, el radio atómico del elemento sólo disminuye ligeramente. Esto es porque tienen la misma cantidad de electrones s, pero sólo difieren en el número de electrones d. Estos electrones d se encuentran en una capa interna (capa penúltima) y los electrones son progresivamente añadidos a este nivel, sin crear nuevos niveles. Los electrones d no son buenos para apantallar la carga nuclear, por lo que el radio atómico no cambia mucho cuando se agregan nuevos electrones. Casi como sin tener en cuenta los electrones D que se agrega.[2]
Véase también
- Contracción lantánida o contracción del bloque f.
- Contracción actínida
Referencias
- ↑ Group 13. Background, Occurrence, & Isolation. David Rieck. Facultad de Química. Universidad de Salisbury.
- ↑ http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Transition_Metals_and_Coordination_Complexes/The_Lanthanides/Lanthanide_Contraction#D_Block_Contraction_(Scandide_Contraction) D Block Contraction (Scandide Contraction). Amrit Paul Bains (University of California, Davis). ChemWiki
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
Wikimedia foundation. 2010.