- Compuestos de zinc
-
Los compuestos de zinc son compuestos químicos que contienen el elemento zinc, que pertenece al grupo 12 de la tabla periódica. El estado de oxidación de la mayoría de sus compuestos es 2, el estado de oxidación principal de los otros elementos del grupo. El zinc puede ser clasificado como elemento de post-transición, pues el zinc (II) tiene un comportamiento químico similar al cobre (II), o como elemento representativo. Muchas sales de zinc (II) son isomorfas con las sales de magnesio (II), debido a que los radios iónicos de los cationes son muy parecidos. El zinc forma muchos complejos; metalo-proteínas que contienen zinc son comunes en los sistemas biológicos[1] [2] [3] [4]
Contenido
Características generales
 Muestra microscópica de cloruro tetrabásico de zinc
Muestra microscópica de cloruro tetrabásico de zinc
Los átomos de zinc tienen un configuración electrónica de [Ar]3d104s2. Cuando se forman los compuestos con estado de oxidación 2+, se pierden los dos electrones s, por lo que el ion zinc desnudo tiene la configuración electrónica [Ar]3d10. Esto permite la formación de cuatro enlaces covalentes, al aceptar cuatro pares de electrones y por lo tanto cumpliría la regla del octeto. La estereoquímica es tetraédrica y los enlaces puede ser descritos como formados por orbitales híbridos sp3 en el ion zinc. Algunos ejemplos se presentan en el óxido, ZnO, (cincita) y el sulfuro, ZnS, (blenda) en el que los iones óxidos y sulfuros están también tetraédricamente conectados a cuatro iones zinc. Muchos complejos de coordinación, como ZnCl42-, son tetraédricos. El zinc coordinado en tetraedros se encuentra en metalo-enzimas como la anhidrasa carbónica. Sin embargo, pueden formarse también complejos con índice de coordinación seis mediante el uso de orbitales 4d vacíos para formar orbitales híbridos sp3d2. El ion [Zn(H2O)62+, que se presenta cuando una sal de zinc se disuelve en agua, tiene una estructura octaédrica.
Muchas sales de zinc (II) son sales isomorfas (tienen el mismo tipo de estructura cristalina) que las correspondientes sales de magnesio (II), debido al hecho de que el Zn2+ y Mg2+ tienen casi idénticos radios iónicos. Esto se produce debido a la contracción del bloque d. Mientras que el calcio es algo más grande que el magnesio, hay una constante disminución de tamaño a medida que aumenta el número atómico desde el calcio hasta el zinc. Por casualidad, el radio iónico del zinc es casi igual al del magnesio. En la mayoría de los demás aspectos, la química del zinc (II) es más parecida a la química del cobre (II), su vecino en la tabla periódica, que posee menos electrones. Sin embargo, mientras que Cu2+ se clasifica como un ion de metal de transición en virtud de su configuración electrónica [Ar]3d9, en el que hay una capa o nivel d incompleto, el Zn2+ es mejor considerado como un ion de elemento representativo de post-transición. La tabla periódica de la IUPAC sitúa el zinc en el bloque d.
Se conocen algunos compuestos de zinc con estado de oxidación 1+[5] Los compuestos tienen la fórmula RZn2R y contienen un enlace Zn-Zn análogo al enlace metal-metal del mercurio (I) en los iones Hg22+. En este sentido zinc es similar al magnesio en el que se conocen compuestos de magnesio de baja valencia que contienen un enlace Mg - Mg.[6]
No se conoce ningún compuesto de zinc con estado de oxidación distinto de 1+ o 2+. Los cálculos indican que es improbable que exista un compuesto de zinc con el estado de oxidación de 4+.[7] Aunque los mayores estados de oxidación son más estables para los elementos más pesados de un grupo, el compuesto fluoruro de mercurio (IV), HgF4, existe sólo a 4 K en una matriz de neón/argón.[8]
Color y magnetismo
Los compuestos de zinc, como los compuestos de los elementos representativos, son en su mayoría incoloros. Las excepciones se producen cuando el compuesto contiene un anión o ligando coloreados. El seleniuro de zinc (ZnSe), sin embargo, es de color amarillo, debido a transiciones en la transferencia de carga, y el telururo de zinc (ZnTe) es de color marrón por la misma razón. El óxido de zinc se vuelve amarillo cuando se calienta debido a la pérdida de algunos átomos de oxígeno y la formación de un defecto en la estructura.
Los compuestos que contienen zinc y otros metales son todos diamagnéticos.
Reactividad del metal
El zinc es un fuerte agente reductor con un potencial redox estándar de -0,76 V. El zinc puro se empaña rápidamente en el aire, formando una capa pasiva de carbonato básico de zinc, Zn5(OH)6CO3.[9] La reacción del cinc con el agua es impedida por la capa pasiva. Cuando esta capa es penetrada por ácidos como el ácido clorhídrico y el ácido sulfúrico la reacción tiene lugar con desprendimiento de gas hidrógeno.[1] [10]
- Zn(s) + 2H+ (aq) → Zn2+ (aq) + H2 ↑
Los iones hidrógeno se reducen al aceptar un electrón del agente reductor. El zinc metálico se oxida. La amalgamación con mercurio, como en el reductor de Jones también destruye la capa pasiva. El zinc reacciona tanto con los álcalis como con los ácidos. Reacciona directamente con oxidantes no metales como los elementos calcógenos y halógenos para formar compuestos binarios.
Compuestos binarios
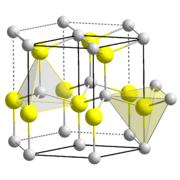 Estructura de la wurtzita, que muestra la geometría tetraédrica de los dos átomos de Zn y S
Estructura de la wurtzita, que muestra la geometría tetraédrica de los dos átomos de Zn y S
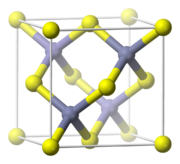 Celda unidad de la blenda
Celda unidad de la blenda
El óxido de zinc, ZnO, es el más importante entre los compuestos fabricados de zinc, con una amplia variedad de usos.[2] Cristaliza con la estructura de la wurtzita. Es anfótero, se disuelve en ácidos para dar una disolución acuosa de iones Zn2+, y en álcalis para dar el complejo tetraédrico con ligandos hidroxo, [Zn(OH)4]2-. El hidróxido de zinc, Zn(OH)2 también es anfótero.
El sulfuro de zinc, ZnS, cristaliza en dos estructuras muy relacionadas, la estructura de la blenda de zinc y la estructura de la wurtzita, que son las estructuras comunes de compuestos con la fórmula MA. Tanto el Zn como el S están tetraédricamente coordinados por los otros iones. Una propiedad útil del ZnS es su fosforescencia. Los otros calcogenuros, ZnSe y ZnTe, tienen aplicaciones en electrónica y óptica.[11]
De los cuatro haluros, el iónico, mientras que los otros, ZnCl2, covalente.[2] Los iones negativos de elementos del grupo del nitrógeno, editar] Sales
El nitrato agente oxidante, el clorato Zn(ClO3)2, el sulfato ZnSO4 (conocido como vitriolo blanco), el fosfato pigmento en imprimación, el molibdato koettigita) son algunos ejemplos de otros compuestos inorgánicos de zinc comunes. Estos dos últimos compuestos son usados en insecticidas y conservantes de la madera.[15] Uno de los ejemplos más simples de un compuesto orgánico de zinc es el acetato Zn(O2CCH3)2, que tiene varias aplicaciones medicinales. Las sales de zinc están por lo general totalmente disociadas. En una disolución acuosa se producen excepciones cuando el anión puede formar un complejo, como en el caso del sulfato de zinc, donde se puede formar el complejo [Zn(H2O)n(SO4], (log K= 2,5 aprox.).[16]
Complejos
La estructura más común de los complejos de zinc es tetraédrica, que está claramente relacionada con el hecho de que se cumple la regla del octeto en estos casos. Sin embargo, no son raros los complejos octaédricos comparables a los de otros elementos de transición. El ion Zn2+ es un aceptor de clase A en la clasificación de Ahrland, Chatt y Davies,[17] y por lo tanto forma complejos más fuertes con los átomos donantes del segundo período, oxígeno o nitrógeno, que con el azufre (período 3) o el fósforo. En términos de la teoría HSAB, el ion Zn2+ es un ácido fuerte.
En una solución acuosa de un complejo octaédrico, [Zn(H2O)6]2+ es la especie predominante.[18] Las disoluciones acuosas de sales de zinc son levemente ácidas, ya que los iones metálicos en disolución acuosa están sujetos a hidrólisis con [Zn(H2O)5(OH)]+ + H+
La hidrólisis explica por qué son fáciles de obtener las sales básicas como el acetato básico de zinc y el carbonato básico de zinc, Zn3(OH)4(CO3).H2O. La razón de la hidrólisis es la alta densidad de carga eléctrica en el ion zinc, que desplaza los electrones de un enlace OH de una molécula de agua coordinada y libera un ion hidrógeno. El efecto polarizador de Zn2+ es parte de la razón por la que el zinc se encuentra en enzimas como la anhidrasa carbónica.
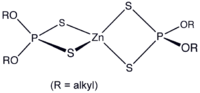
No son conocidos los complejos de fluor, pero sí se pueden preparar complejos con los otros haluros y con pseudohaluros, [ZnX3]- y [ZnX4]2- . El caso del complejo tiocianato ilustra el carácter de clase A de los iones zinc, ya que es el isómero unido al átomo de N, [Zn(NCS)4]2- a diferencia de [Cd(SCN)4]2-, donde está unido al átomo de S. Ser un aceptor de clase-A no impide la formación de complejos con átomos donantes de azufre, como ocurre en ditiofosfato de zinc y en el complejo de los dedos de zinc (abajo).
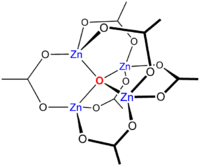
El complejo acetilacetonato, Zn(acac)2 es interesante. Como el ligando es bidentado se podría esperar una estructura tetraédrica. Sin embargo, el compuesto es de hecho un trímero, Zn3(acac)6 en el que cada ion Zn está coordinado con cinco átomos de oxígeno en una estructura de bipirámide trigonal distorsionada.[2] Otros estructuras con índice de coordinación 5 pueden ser modificadas por la elección de ligandos que tienen requisitos específicos de estereoquímica. Por ejemplo, la terpiridina, que es un ligando tridentado forma el complejo [Zn(terpy)Cl2]. Otro ejemplo podría implicar un ligando trípode como tris(2-aminoetil)amina. El compuesto cianuro de zinc, cianuro. El grupo cianuro muestra la alteración cabeza-cola con cualquier átomo de zinc que tenga entre 1 y 4 átomos de carbono vecinos, mientras los demás sean átomos de nitrógeno. Estos dos ejemplos ilustran la dificultad de relacionar a veces la estructura con la estequiometría.
Un número de coordinación 2 aoparece en la amida Zn(NR1R2)2 (R1=CMe3, R2=SiMe3); el ligando es tan voluminoso que no hay suficiente espacio para más de dos de ellos[20]
Bio-complejos
Un gran número de metalo-enzimas contienen zinc (II). También muchas proteínas contienen zinc, por razones estructurales. El ión zinc está siempre en coordinación 4 con al menos tres ligandos que son cadenas laterales de aminoácidos. El nitrógeno del imidazol de una cadena lateral de histidina es un ligando común. Los siguientes son ejemplos típicos de los dos tipos de complejos zinc-proteínas.
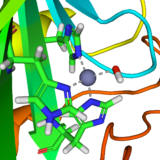
En el sitio activo de la anhidrasa carbónica en reposo, un ion zinc está coordinado con tres residuos de histidina. La cuarta posición está ocupada por una molécula de agua, que está fuertemente polarizada como en la hidrólisis (ver arriba). Cuando el dióxido de carbono entra en el sitio activo, se somete a un ataque nucleófilo por el átomo de oxígeno que transporta una carga parcial negativa, o incluso una carga negativa total si la molécula de agua se disocia. El CO2 se convierte rápidamente en un ion bicarbonato.[21]
- [(-hys)3Zn(H2O)]2+ + CO2 → [(-hys)3Zn]2+ + HCO3- + H+
Algunas peptidasas, por ejemplo, la glutamato carboxipeptidasa II se cree que actúan de manera similar, con los iones zinc promoviendo la formación de un reactivo nucleofílico.[21]
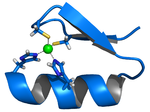
El motivo dedo de zinc es una subestructura rígida de una proteína que facilita la unión de la proteína a otra molécula, tales como ADN.[22] En este caso, las cuatro posiciones de coordinación están ocupadas por residuos de histidina y cisteína. La geometría tetraédrica alrededor del ion zinc limita un fragmento de hélice α y un fragmento antiparalelo de lámina β de una orientación particular de una con respecto a la otra.
Los iones de magnesio, que tienen una mayor concentración en los fluidos biológicos, no pueden realizar estas funciones pues sus complejos son mucho más débiles que los de zinc.
Compuestos organometálicos de zinc
Los compuestos de organozinc contienen enlaces covalentes zinc-carbono. El dietilzinc ((C2H5)2Zn) fue sintetizado por primera vez en 1848, por reacción de zinc y yoduro de etilo y es el primer compuesto del que se supo que contienen un enlace sigma metal-carbono.[23] Durante mucho tiempo fue un misterio por qué el cobre (II) no formaba un compuesto análogo. En la década de 1980 se encuentró la razón: el compuesto de zinc no sufre la reacción de eliminación de hidruro en posición beta, mientras que el compuesto de cobre, un metal de transición, sí lo hace. Los compuestos de alquilzinc y arilzinc contienen la cadena C-Zn-C. Debido a que el centro de zinc está coordinativamente insaturado, el compuesto es un poderoso electrófilo. De hecho, los compuestos de bajo peso molecular se inflaman espontáneamente en contacto con el aire y se destruyen de inmediato por reacción con moléculas de agua. El uso de compuestos de alquilzinc ha sido reemplazado en gran parte por el uso de los más fáciles de manejar reactivos de Grignard. Esto demuestra una nueva conexión entre la química del zinc y la del magnesio.
El cianuro de zinc, decametildizincoceno.[25]
Véase también
- telururo de zinc y cadmi
- telururo de mercurio y cadmio
- gluconato de zinc
- piritionato de zinc
- ricinoleato de zinc
- estearato de zinc
- Peste del zinc
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Compuestos de zinc. Commons
Wikimedia Commons alberga contenido multimedia sobre Compuestos de zinc. Commons
Referencias
- ↑ a b Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils; (1985). «Zink» (en German). Lehrbuch der Anorganischen Chemie (91–100 edición). Walter de Gruyter. pp. 1034–1041. ISBN 3-11-007511-3.
- ↑ a b c d Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0-08-037941-9
- ↑ Housecroft, C. E.; Sharpe, A. G. (2008). Inorganic Chemistry (3rd ed.). Prentice Hall. ISBN 978-0-13-175553-6.
- ↑ Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry (6ª ed.), Nueva York: Wiley-Interscience, ISBN 0-471-19957-5
- ↑ Wang, Yuzhong; Brandon Quillian, Pingrong Wei, Hongyan Wang, Xiao-Juan Yang, Yaoming Xie, R. Bruce King, Paul v. R. Schleyer, H. Fritz Schaefer, III, and Gregory H. Robinson (2005). On the Chemistry of Zn−Zn Bonds, RZn−ZnR (R = [{(2,6-Pri2C6H3)N(Me)C}2CH]): Synthesis, Structure, and Computations. 127. doi:.
- ↑ Green, S. P.; Jones C.; Stasch A. (December 2007). «Stable Magnesium(I) Compounds with Mg-Mg Bonds». Science 318 (5857): pp. 1754–1757. doi:. PMID 17991827.
- ↑ Kaupp M. ; Dolg M. ; Stoll H. ; Von Schnering H. G. (1994). «Oxidation state +IV in group 12 chemistry. Ab initio study of zinc(IV), cadmium(IV), and mercury(IV) fluorides». Inorganic chemistry 33 (10): pp. 2122–2131. doi:. http://pubs.acs.org/doi/pdf/10.1021/ic00088a012.
- ↑ Xuefang Wang; Lester Andrews; Sebastian Riedel; and Martin Kaupp (2007). "Mercury Is a Transition Metal: The First Experimental Evidence for HgF4.". Angew. Chem. Int. Ed. 46 (44): 8371–8375. doi 10.1002/anie.200703710 PMID 17899620
- ↑ Porter, Frank C. (1994). Corrosion Resistance of Zinc and Zinc Alloys. CRC Press. pp. 121. ISBN 0-82-479213-0.
- ↑ Heiserman, David L. (1992). «Element 30: Zinc». Exploring Chemical Elements and their Compounds. New York: TAB Books. p. 123–124. ISBN 0-8306-3018-X.
- ↑ «Zinc Sulfide». American Elements. Consultado el 03-02-2009.
- ↑ Grolier Incorporated (1994). Academic American Encyclopedia. Danbury, Connecticut: Grolier Inc.. p. 202. ISBN 0717220532. http://books.google.com/?id=YgI4E7w5JI8C&dq=%22zinc+nitride%22&q=%22zinc+nitride%22. Consultado el 01-11-2007.
- ↑ «Zinc Phosphide». American Elements. Consultado el 03-02-2009.
- ↑ Shulzhenko, A. A.; Ignatyeva, I. Yu.; Osipov A. S.; Smirnova T. I. (2000). «Peculiarities of interaction in the Zn–C system under high pressures and temperatures». Diamond and Related Materials 9 (2): pp. 129–133. doi:.
- ↑ Perry, D. L. (1995). Handbook of Inorganic Compounds. CRC Press. pp. 448–458. ISBN 0-8492-8671-3.
- ↑ IUPAC SC-Database
- ↑ Ahrland, S.; Chatt, J.; Davies, N.R. (1958). «The relative affinities of ligand atoms for acceptor molecules and ions». Quart. Rev. 12: pp. 265–276. doi:.
- ↑ Burgess, J. Metal ions in solution, (1978) Ellis Horwood, New York. p 147
- ↑ Baes, C.F.; Mesmer, R.E. The Hydrolysis of Cations, (1976), Wiley, New York
- ↑ Rees, W.S; Green, D.M.; Hesse, W. (1992). «Synthesis and X-ray diffraction crystal structure of ZnN(C(CH3)3)(Si(CH3)3)2. The first solid-state homoleptic zinc amide to be structurally characterized (La primera amida de zinc homoléptica caracterizada estructuralmente en estado sólido)». Polyhedron 11: pp. 1697–1699. doi:.
- ↑ a b Shriver, D.F.; Atkins, P.W. (1999). «Chapter 19, Bioinorganic chemistry». Inorganic chemistry (3rd. edición). Oxford University Press. ISBN 019 850330x.
- ↑ Berg JM (1990). «Zinc finger domains: hypotheses and current knowledge». Annu Rev Biophys Biophys Chem 19: pp. 405–21. doi:. PMID 2114117.
- ↑ E. Frankland (1850). «On the isolation of the organic radicals». Quarterly Journal of the Chemical Society 2: pp. 263. doi:.
- ↑ Rasmussen, J. K.; Heilmann, S. M. (1990). «In situ Cyanosilylation of Carbonyl Compounds: O-Trimethylsilyl-4-Methoxymandelonitrile». Organic Syntheses, Collected Volume] 7: pp. 521. http://www.orgsyn.org/orgsyn/prep.asp?prep=cv7p0521.
- ↑ Resa, I.; Carmona, E.; Gutierrez-Puebla, E.; Monge, A. (2004). «Decamethyldizincocene, a Stable Compound of Zn(I) with a Zn-Zn Bond». Science 304 (5687): pp. 1136. doi:. PMID 15326350.
Wikimedia foundation. 2010.