- Escandio
-
Escandio
Calcio - Escandio - Titanio Sc
Y
La
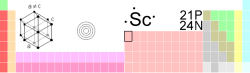
General Nombre, símbolo, número Escandio, Sc, 21 Serie química Metal de transición Grupo, periodo, bloque 3, 4, d Densidad, dureza Mohs 2985 kg/m3, _ Apariencia blanco plateado

Propiedades atómicas Masa atómica 44,955910 u Radio medio† 160 pm Radio atómico calculado 184 pm Radio covalente 144 pm Radio de Van der Waals sin datos Configuración electrónica [Ar]4s2 3d1 Estados de oxidación (Óxido) 3 (base débil) Estructura cristalina Hexagonal Propiedades físicas Estado de la materia Sólido (__) Punto de fusión 1814 K Punto de ebullición 3103 K Entalpía de vaporización 314,2 kJ/mol Entalpía de fusión 14,1 kJ/mol Presión de vapor 22,1 Pa a 1812 K Velocidad del sonido sin datos m/s a 293,15 K Información diversa Electronegatividad 1,36 (Pauling) Calor específico 568 J/(kg*K) Conductividad eléctrica 1,77 106 m-1·Ω-1 Conductividad térmica 15,8 W/(m*K) 1er potencial de ionización 633,1 kJ/mol 2° potencial de ionización 1235,0 kJ/mol 3er potencial de ionización 2388,6 kJ/mol 4° potencial de ionización 7090,6 kJ/mol 5° potencial de ionización 8843 kJ/mol 6° potencial de ionización 10679 kJ/mol 7° potencial de ionización 13310 kJ/mol 8° potencial de ionización 15250 kJ/mol 9° potencial de ionización 17370 kJ/mol 10° potencial de ionización 21726 kJ/mol Isótopos más estables iso. AN Periodo de semidesintegración MD ED MeV PD 45Sc 100% Sc es estable con 24 neutrones 46Sc Sintético 83,79 días β- 2,367 46Ti Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
†Calculado a partir de distintas longitudes
de enlace covalente, metálico o iónico.El escandio es un elemento químico de la tabla periódica cuyo símbolo es Sc y su número atómico es 21. Es un metal de transición que se encuentra en minerales de Escandinavia y que se clasifica con frecuencia entre los lantánidos por sus similitudes con ellos.
Contenido
Características principales
Es un metal blando, muy ligero, resistente el ataque del ácido nítrico y fluorhídrico, de color plateado deslustra expuesto al aire adoptando un color ligeramente rosado. Su estado de oxidación más común es +3 y sus sales son incoloras. Sus propiedades son más parecidas a las del itrio y los lantánidos que a las del titanio por lo que suele incluirse con frecuencia entre las tierras raras.
Aplicaciones
El óxido de escandio Sc2O3, se utiliza en luces de alta intensidad y añadido yoduro de escandio en las lámparas de vapor de mercurio se consigue una luz solar artificial de muy alta calidad. El isótopo radiactivo Sc-46 se usa en el craqueo del petróleo como trazador, y el metal tiene aplicación en la industria aeroespacial dado que presenta un punto de fusión muy superior al del aluminio.
Historia
El escandio (del latín científico scandĭum, y éste de Scandi, Escandinavia) fue descubierto por Lars Fredrick Nilson en 1879 mientras trabajaba con su equipo en la búsqueda de metales tierras raras mediante análisis espectral de los minerales euxenita y gadolinita. Para aislar el elemento procesó 10 kg de euxenita con otros residuos de tierras raras logrando aproximadamente 2 gramos de óxido (Sc2O3) de gran pureza.
En 1869 Dmitri Mendeleyev predijo, basándose en las leyes periódicas, que este metal debía tener propiedades similares a las del boro por lo que llamó al elemento aún por descubrir ekaboro (símbolo Eb). Aproximadamente en la misma época que Nilson, Per Theodor Cleve descubrió el óxido de escandio y confirmó que se trataba del ekaboro.
En 1937 se aisló por vez primera el metal por electrólisis de una solución eutéctica de potasio, litio y cloruros de escandio a 700-800 °C empleando como electrodos un filamento de wolframio y un baño de cinc líquido en un crisol de grafito. La primera libra de escandio del 99% de pureza se fabricó en 1960.
Abundancia y obtención
Las únicas fuentes concentradas conocidas del metal, que no se encuentra en estado nativo, son minerales poco abundantes de Escandinavia y Madagascar como euxenita, gadolinita y thortveitita.
Es más abundante en el sol y estrellas similares (23º) que en la Tierra (50º) donde se encuentra muy repartido, apareciendo trazas del metal en más de 800 minerales. El color azul del aguamarina, variedad del berilo, se cree que se debe a la presencia de escandio y aparece entre los residuos de la wolframita tras la extracción del wolframio.
La thortveitita es la principal mena de escandio siendo otra fuente importante los residuos de la extracción del uranio donde se obtiene como subproducto. El metal se obtiene industrialmente por reducción del fluoruro de escandio con calcio.
Isótopos
El escandio natural tiene un único isótopo estable, el Sc-45. Se conocen 13 isótopos radiactivos de los que los más estables son el Sc-46 con un periodo de semidesintegración de 83,79 días, el Sc-47 (3,3492 días) y Sc-48 (43,67 horas); los demás isótopos radiactivos tiene periodos de semidesintegración inferiores a las 4 horas y la mayoría menores de 2 minutos. Se conocen además 5 estados metaestables, siendo el más estable el Scm-44 (periodo de semidesintegración de 58,6 horas).
La masa atómica de los isótopos de escandio varía desde 39,978 uma del Sc-40 hasta 53,963 uma del Sc-54. El modo de desintegración principal de los isótopos más ligeros que el estable (Sc-45) es la captura electrónica originándose isótopos de calcio, mientras que los isótopos más pesados que el estable se desintegran principalmente mediante emisión beta dando lugar a isótopos de titanio.
Precauciones
El polvo de escandio metálico es inflamable.
Referencias
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Escandio.Commons
Wikimedia Commons alberga contenido multimedia sobre Escandio.Commons- WebElements.com - Scandium
- EnvironmentalChemistry.com - Scandium
Categoría: Elementos químicos
Wikimedia foundation. 2010.
