- Halogenación electrofílica
-
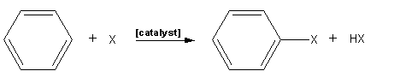
En química orgánica, una halogenación aromática electrofílica es un tipo de sustitución aromática electrofílica. Esta reacción orgánica es típica de los compuestos aromáticos y es un método muy útil para añadir sustituyentes a un sistema aromático.
Algunos tipos de compuestos aromáticos, tales como fenol, van a reaccionar sin un catalizador, pero para los derivados del benceno típicos frente a sustratos menos reactivos, es necesario un ácido de Lewis como catalizador. Entre los ácidos Lewis que actúan como catalizadores habituales tenemos al AlCl3, FeCl3,
Mecanismo de reacción
El mecanismo de reacción para la cloración del benceno es el misma que para la bromación del benceno. El bromuro de hierro (III) y el cloruro de hierro (III) se inactivan si reaccionan con el agua, incluyendo la humedad del aire. Por lo tanto, son generados in situ mediante la adición de limaduras de hierro al bromo o al cloro.
El mecanismo de yodación es ligeramente diferente: el yodo (I2) se trata con un agente oxidante como el ácido nítrico para obtener el yodo electrófilo (2 I+). En un estudio el reactivo de yodación fue una mezcla de yodo y ácido iódico.[1]
En otra serie de estudios se usó un poderoso reactivo obtenido utilizando una mezcla de yodo y yodato de potasio concentrado disuelto en ácido sulfúrico. Aquí el agente de yodación es el catión triyodo, I3+, y la base es el ion hidrogenosulfato, HSO4-. En estos estudios, fueron investigados tanto la cinética de la reacción como las condiciones de preparación de compuestos fuertemente desactivados para la yodación, como el ácido benzoico y el 3-nitrobenzotrifluoruro.[2] [3]
La halogenación de compuestos aromáticos se diferencia de la halogenación de alquenos , que no requieren de un ácido de Lewis como catalizador. T La formación del ion arenio da como resultado una pérdida temporal de la aromaticidad, que tiene una mayor energía de activación en comparación con la formación de carbocatión en alquenos. En otras palabras, los alquenos son más reactivos y no necesitan tener debilitado el enlace Br-Br o Cl-Cl.
Ámbito de aplicación
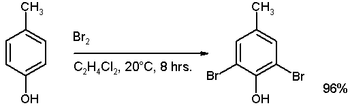
Si el anillo contiene un sustituyente fuertemente activador como los grupos -OH, -OR o aminas, no es necesario un catalizador, por ejemplo, en la bromación del p-cresol:[4]
Sin embargo, si se utiliza un catalizador con exceso de bromo, a continuación, se formará un tribromuro.
La halogenación de los fenoles más rápida en disolventes polares debido a la disociación del fenol, siendo los iones fenóxido más susceptibles al ataque electrofílico ya que son más ricos en electrones.
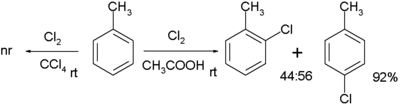
La cloración del tolueno con cloro sin catalizador requiere un disolvente polar, tal como el ácido acético. La selectividad para el derivado orto es baja:[5]
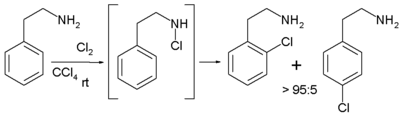
En contraste, cuando el reactivo es 2-feniletilamina, es posible emplear disolventes relativamente apolares con orto- regioselectividad exclusiva, debido a la formación intermedia de una cloramina que da paso a la siguiente etapa de la reacción intramolecular.
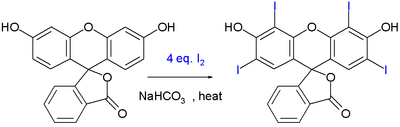
El colorante alimenticio eritrosina pueden ser sintetizado por yodación de otro colorante llamado fluoresceína:
Esta reacción es impulsada por el hidrogenocarbonato de sodio.[6]
Referencias
- ↑ Regioselective iodination of hydroxylated aromatic ketones Bhagwan R. Patila, Sudhakar R. Bhusarec, Rajendra P. Pawara, and Yeshwant B. Vibhute b Arkivoc 2006 (i) 104-108. Online Article
- ↑ The kinetics of aromatic iodination by means of the tri-iodine cation, J. Arotsky, A. C. Darby and J. B. A. Hamilton, J. Chem. Soc. B, 1968, 739 - 742
- ↑ Iodination and iodo-compounds Part IV, Judah Arotsky, A. Carl Darby and John B. A. Hamilton, J. Chem. Soc., Perkin Trans. 2, 1973, 595 - 599
- ↑ A. Sankaranarayanan and S. B. Chandalia (2006). «Process Development of the Synthesis of 3,4,5-Trimethoxytoluene». Org. Process Res. Dev. 10 (3): pp. 487–492. doi:.
- ↑ J. L. O'Connell, J. S. Simpson, P. G. Dumanski, G. W. Simpson and C. J. Easton (2006). «Aromatic chlorination of ω-phenylalkylamines and ω-phenylalkylamides in carbon tetrachloride and α,α,α-trifluorotoluene». Organic & Biomolecular Chemistry 4 (14): pp. 2716–2723. doi:.
- ↑ Synthesis of Triarylmethane and Xanthene Dyes Using Electrophilic Aromatic Substitution Reactions James V. McCullagh and Kelly A. Daggett J. Chem. Educ. 2007, 84, 1799. Abstract
Categorías:- Reacciones de sustitución
- Reacciones químicas orgánicas
Wikimedia foundation. 2010.