- Capa electrónica
-
La capa electrónica, capa de electrones o cubierta de electrones puede pensarse como una órbita seguida por electrones alrededor del núcleo de un átomo. Por que cada capa contiene un cierto número de electrones, cada capa es asociada con un particular rango de energía, y por lo tanto cada capa debe de llenarse completamente antes de poder agregar más electrones a la capa exterior. Los electrones en la última capa determinan las propiedades químicas del átomo (ver capa de valencia).
Las capas electrónicas son simbolizadas mediante letras, sucesivamente, partiendo de la más cercana al núcleo:
- La primera capa es la capa K, n = 1
- Luego viene la capa L , n = 2
- Luego la capa M, n = 3
- Luego la capa N, n = 4
- Luego la capa O, n = 5
- Luego la capa P, n = 6
- Luego la capa Q, n = 7
Hay una fórmula para determinar el número de electrones que puede tener una capa: 2n².
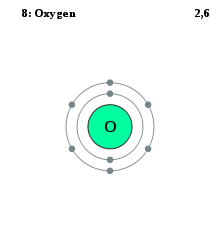
La capa K (común a todos los Elementos químicos ), posee hasta dos electrones, la capa L puede tener hasta 8 electrones, la capa M 18, la capa de N 32, la capa de O 50, la capa P 72 y la capa Q 98. El número de capas de un átomo depende del número de electrones del átomo. Los electrones se disponen con prioridad en la capa más cercana al núcleo hasta que ésta se satura (se alcanza el número máximo de electrones), los electrones restantes se colocan en la siguiente capa hasta que está saturada y así sucesivamente, hasta que ya no hay electrones. Por lo tanto, un átomo de hidrógeno, que tiene un electrón, sólo tiene una capa , la capa K que está parcialmente llena (un electrón de un máximo de dos). Un átomo de helio, que tiene dos electrones, éstos se distribuyen en la capa K que está completamente llena (dos electrones de un máximo de dos). Por lo tanto, el átomo de litio, que tiene tres electrones, tiene una capa K saturada (con los dos primeros electrones), y una capa L que contiene el tercer electrón.
Una capa se dice que está saturada si contiene su número máximo de electrones. La capa K de los átomos de helio y litio está pues saturada.
Contenido
Historia
La existencia de capas de electrones fue observada por primera vez en el rayo X de Charles Barkla y Henry Moseley. Barkla las llamo con las letras K, L, M, N, O, P, y Q. El origen de esta terminología fue alfabético. Una capa J fue sospechada, pero otros experimentos indicaron que las líneas de absorción de K eran producidas por la primera capa de electrones.
El nombre de las capas de electrones se deriva del modelo de Bohr, en el cual se pensaba que los grupos de electrones orbitaban el núcleo a ciertas distancias, así que sus orbitas formaban capas alrededor de los núcleos.
El fisicoquímico Gilbert Lewis fue el responsable de mucho del desarrollo temprano de la teoría de la participación de los electrones de la capa de valencia en los enlaces químicos. Linus Pauling después generalizo y expandió la teoría al aplicar nociones de la mecánica estructura.
Ejemplo
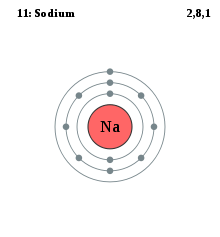
El sodio tiene once electrones. Su estructura electrónica es la siguiente:(K)2 (L)8 (M)1. Las capas K y L están saturadas.
El número máximo de electrones permitidos en cada capa no es cualquiera. Según el principio de Pauli, es igual a 2n² para la nésima capa. Se completará con 2 electrones en la capa K, 8 en la capa L, 18 en la M, etc. En resumen:(K)2(L)8(M)18(N)32(O)50(P)72 ...
Este modelo de llenado de las capas electrónicas ha sido cuestionado por la física cuántica con un modelo más complejo, pero que parece más próximo a la realidad a escala atómica: Además de las capas, debe tenerse en cuenta la existencia de subcapas electrónicas denominadas s, p, d, f, g, y que tienen sus propios números máximos de electrones para estar saturadas.
Las cosas se complican desde el átomo de potasio (Z = 19): El 19e electrón se coloca en la capa de N, mientras que la capa M no está saturada (puede contener 18 electrones, a pesar de que sólo contiene 8).
Así, para el átomo de potasio, tenemos:(K)2(L)8(M)8(N)1 en lugar de (K)2(L)8(M)9.
Lo mismo ocurre con el átomo de calcio (Z = 20), pero para los átomos con un número atómico entre el 20 y 30, los 20ésimos a 30ésimos electrones se colocan en la capa M, que terminan de llenar antes de llenar la capa N.
- Ejemplos:
Véase también
Notas
- Este artículo fue creado a partir de la traducción del artículo Couche électronique de la Wikipedia en francés, bajo licencia Creative Commons Atribución Compartir Igual 3.0 y GFDL.
Enlaces
 Wikimedia Commons alberga contenido multimedia sobre las capas electrónicasCommons.
Wikimedia Commons alberga contenido multimedia sobre las capas electrónicasCommons.
Thomas Muller
Wikimedia foundation. 2010.