- Nonano
-
Nonano[1]
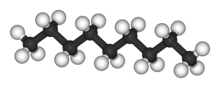
Nombre (IUPAC) sistemático Nonano General Fórmula semidesarrollada C9H20 Fórmula estructural CH3-(CH2)7CH3 Fórmula molecular n/d Identificadores Número CAS 111-84-2 Propiedades físicas Estado de agregación líquido Apariencia incoloro Densidad 718 kg/m3; 0,718 g/cm3 Masa molar 128.2 g/mol g/mol Punto de fusión 220 K (-53,15 °C) Punto de ebullición 424 K (150,85 °C) Temperatura crítica 594 K ( °C) Índice de refracción 1,403 Propiedades químicas Solubilidad en agua 0,7 g/100 mL
Inmiscible con aguaCompuestos relacionados Octano Decano Bioquímica Familia Alcanos Termoquímica ΔfH0gas -229 kJ/mol kJ/mol Peligrosidad Punto de inflamabilidad 304 K (31 °C) NFPA 704 Temperatura de autoignición 478 K (205 °C) Límites de explosividad 0,8-2,9% (vol. aire) Riesgos Inflamable (Clase F)[2] Ingestión Náuseas, vómitos. Inhalación Ataxia, convulsiones, tos, pérdida del conocimiento. Piel Piel seca, enrojecimiento. Ojos Enrojecimiento. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl nonano es un alcano, hidrocarburo saturado o parafina de cadena lineal cuya fórmula química es CH3(CH2)7CH3. Su radical sustituyente recibe el nombre de nonil, CH3(CH2)7CH2- , y su equivalente estructural en forma de anillo es el ciclononano (C9H18). A diferencia de otros alcanos, el prefijo que aparece en su nombre y que indica el número de átomos de carbono procede del latín, no del griego.
Contenido
Estructura de la molécula
Es un compuesto covalente, no ramificado, formado por un esqueleto de átomos de carbono rodeado por átomos de hidrógeno. La cadena tiene forma de zig-zag, con ángulos aproximados de 108º.
A la derecha, se observan dos modelos de la molécula de nonano: el esqueleto carbonado (arriba) y una representación de la molécula usando el modelo de bolas y varillas.
Propiedades
Es un líquido poco volátil que arde con facilidad. Su densidad en estado líquido es menor que la del agua, siendo muy poco soluble en ella. Se disuelve bien en disolventes orgánicos, como alcohol, acetona, tetracloruro de carbono.
Reacciones
- Combustión, con formación de dióxido de carbono y agua:

- Halogenación (bromación) en presencia de luz visible o ultravioleta, y a temperatura elevada:[3]

- Por pirólisis se obtiene una mezcla de alcanos de cadena más corta, alquenos e hidrógeno.
- Pirólisis al vapor, cracking, cracking hidrolítico y craking catalítico son otras reacciones en las que se consigue obtener moléculas más pequeñas.[3]
Isómeros del nonano
Hay 35 posibles isómeros de cadena de diferente longitud y ramificación, aunque sólo 10 de ellos han sido encontrados y se conocen algunas de sus propiedades.:
- 2-metiloctano; 3-metiloctano y 4-metiloctano.
- 2-etilheptano; 3-etilheptano y 4-etilheptano.
- 2,2-dimetilheptano; 2,3-dimetilheptano; 2,4-dimetilheptano; 2,5-dimetilheptano; 2,6-dimetilheptano.
- 3,3-dimetilheptano; 3,4-dimetilheptano; 3,5-dimetilheptano.
- 4,4-dimetilheptano.
- 3-etil-2-metilhexano y 3-etil-3-metilhexano.
- 4-etil-2-metilhexano y 4-etil-3-metilhexano.
- 2,2,3-trimetilhexano; 2,2,4-trimetilhexano; 2,2,5-trimetilhexano.
- 2,3,3-trimetilhexano, 2,3,4-trimetilhexano y 2,3,5-trimetilhexano.
- 2,4,4-trimetilhexano y 3,3,4-trimetilhexano.
- 3,3-dietilpentano.
- 2,2,3,3-tetrametilpentano, 2,2,4,4-tetrametilpentano.
- 2,2,3,4-tetrametilpentano, 2,3,3,4-tetrametilpentano.
- 3-etil-2,2-dimetilpentano, 3-etil-2,3-dimetilpentano y 3-etil-2,4-dimetilpentano.
Obtención
Se obtiene por destilación fraccionada del petróleo o del gas natural. También puede obtenerse por acoplamiento de halogenuros de alquilo con compuestos organometálicos, como la reacción entre el dietilcuprato de litio con 1-bromoheptano:[4]

Véase también
- Alcanos superiores
Referencias
- ↑ Chemical and physical properties table
- ↑ http://www.insht.es/InshtWeb/Contenidos/Documentacion/FichasTecnicas/FISQ/Ficheros/1201a1300/nspn1245.pdf Fichas internacionales de seguridad química.
- ↑ a b Thornton Morrison, Robert; Neilson Boyd, Robert: Química orgánica.
- ↑ Graham Solomons, T. W.: Organic chemistry. 6ª edición. Wiley ed. 1996. ISBN: 0471013420
Enlaces externos
Categoría:- Alcanos
Wikimedia foundation. 2010.

