- Síntesis de oligonucleótidos
-
La síntesis de oligonucleótidos es la síntesis química de fragmentos relativamente cortos de ácido nucleico con una secuencia estructural química definida. La técnica es extremadamente útil en la práctica actual en laboratorios, porque provee un acceso rápido y barato a oligonucleótidos hechos a medida con una secuencia deseada. Mientras que las enzimas sintetizan ADN y ARN en una dirección de 5' a 3', la síntesis de oligonucleótidos es llevada a cabo en el sentido opuesto, en la dirección 3' a 5'. Actualmente, el proceso está implementado como una síntesis en fase sólida usando el método de la fosforoamidita y bloques de construcción de fosforoamidita derivados de 2'-deoxinucleósidos (dA, dC, dG y T), ribonucleósidos (A, C, G y U), o nucleósidos químicamente modificados, como los ANB. Para obtener el oligonucleótido deseado, se acoplan secuencialmente los bloques de construcción a la cadena de oligonucleótidos en el orden requerido por la secuencia del producto (ver Ciclo de Síntesis más abajo). El proceso ha sido automatizado completamente desde finales de la década de 1970. Al completarse el ensamblado de la cadena, se libera el producto de la fase sólida a la solución, luego se le desprotege, y finalmente se le recolecta. La existencia de reacciones secundarias establece límites prácticos a la longitud de los oligonucleótidos sintéticos (hasta aproximadamente 200 residuos de nucleótido) debido a que el número de errores se acumulan con la longitud del oligonucleótido sintetizado.[1] Los productos suelen ser aislados mediante HPLC para obtener los oligonucleótidos deseados en una alta pureza. Típicamente, los oligonucleótidos sintéticos son moléculas de DNA o RNA de una sola hebra de aproximadamente 15–25 bases de longitud. Comúnmente se les usa como oligonucleótidos de antisentido, SiRNA, partidores para secuenciación de ADN y amplificación, sonda genética para detectar ADN o ARN complementario vía hibridización molecular, herramientas para la introducción dirigida de mutaciones y sitios de restricción, y para la síntesis artificial de genes.
Contenido
Historia
La evolución de la síntesis de oligonucleótidos vio cuatro métodos principales de formación de los enlaces internucleosídicos y ha sido revisada en la literatura con gran detalle.[2] [3] [4]
Primeros trabajos y síntesis contemporánea de H-fosfonato
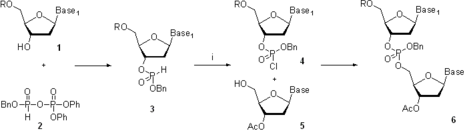
A principios de la década de 1950, el grupo de Alexander Todd fue pionero en los métodos de H-fosfonato y triéster de fosfato para la síntesis de oligonucleótidos.[5] [6] La reacción de los compuestos 1 y 2 para formar el diéster de H-fosfonato 3 es una reacción de copulación en solución, mientras que la de los compuestos 4 y 5 para dar 6 es una copulación fosfotriéster (ver Síntesis fosfotriéster más abajo).
Archivo:H-Phosphonate Cycle.pngEsquema. 2. Ciclo sintético en el método de H-fosfonato par ala síntesis de oligonucleótidos. X = O, STreinta años más tarde, este trabajo inspiró, independientemente, a dos grupos de investigación para adoptar la química de H-fosfonato a la síntesis de fase sólida, usando monoésteres H-fosfonato de nucleósidos 7 como bloques de construcción, y cloruro de pivaloílo, cloruro de 2,4,6-triisopropilsulfonilo (TPS-Cl), y otros compuestos como activadores.[7] [8] La implementación práctica del método del H-fosfonato resultó en un ciclo sintético muy corto y simple, consistiendo de sólo dos etapas, detritilación y copulación (Esquema 2). La oxidación de los enlaces diéster H-fosfonato internucleosídicos en 8 a enlaces fosfodiéster en 9 (X = O) con una solución de yodo en piridina acuosa es llevada a cabo al final del ensamblado de la cadena, como un paso en el ciclo sintético. Alternativamente, 8 puede ser convertido en el fosforotioato 9 (X = S).
Síntesis del fosfodiéster
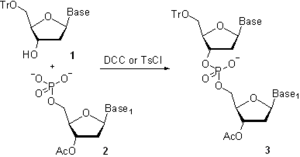
En la década de 1950, Khorana y sus colaboradores desarrollanron un método de fosfodiéster donde el 3’-O-acetilnucleósido-5’-O-fosfato 2(Esquema 3) era activado con N,N’-diciclohexilcarbodiimida (DCC) o cloruro de 4-toluensulfonilo (Ts-Cl) y un nucleósido 5’-O protegido 1 fue hecho reaccionar con la especie activada para dar un monofosfato de dinucleósido protegido 3.[9] Tras la eliminación del grupo acetilo 3’-O usando hidrólisis alcalina, se lleva a cabo una posterior elongación de la cadena. Siguiendo esta metodología, se sintetizaron conjuntos de tri- y tetradeoxirribonucleótidos, los que fueron convertidos enzimáticamente en oligonucleótidos más largos, lo que permitió la elucidación del código genético. La principal limitación del método del fosfodiéster consistía en la formación de oligómeros de pirofosfato y oligonucleótidos ramificados en el fosfato internucleosídico. El método parece ser un paso atrás desde la química más selectiva descrita anteriormente; sin embargo, en aquel entonces, no habían sido introducidos la mayor parte de grupos protectores de fosfato que hay hoy en día. La falta de una estrategia de protección conveniente necesitaba tomar una retirada a una química más lenta y menos selectiva para lograr el objetivo último del estudio.[2]
Síntesis fosfotriéster
Archivo:Phosphotriester method.pngEsquema 4. Acoplamiento de oligonucleótidos por el método del fosfotriéster; MMT = -CPh2(4-MeOC6H4).En la década de 1960, grupos dirigidos por R. Letsinger[10] y C. Reese[11] desarrollaron una solución basada en fosfotriéster. La diferencia que define de la solución basada en fosfodiéster era la protección de la entidad fosfato en el bloque constructor 1 (Esquema 4) y en el producto 3 con el grupo 2-cianoetilo. Esto precluía la formación de oligonucleótidos ramificados en el fosfato internucleosídico. La mayor selectividad del método permitió el uso de agentes copulantes y catalizadores más eficientes,[12] [13] lo que redujo dramáticamente la duración de la síntesis. El método, inicialmente desarrollado para la síntesis en fase de solución, fue también implementado en poliestireno,[14] lo que inició un esfuerzo de investigación masivo en síntesis en fase sólida de oligonucleótidos y condujo eventualmente a la automatización del ensamblaje en las cadenas de oligonucleótidos.
Referencias
- ↑ Beaucage, S.; Iyer, R. (1992). «Advances in the Synthesis of Oligonucleotides by the Phosphoramidite Approach». Tetrahedron 48: pp. 2223. doi:.
- ↑ a b Brown, D. M. A brief history of oligonucleotide synthesis. Methods in Molecular Biology (Totowa, NJ, United States) (1993), 20 (Protocols for Oligonucleotides and Analogs), 1–17.
- ↑ Reese, Colin B. (2005). «Oligo- and poly-nucleotides: 50 years of chemical synthesis». Organic & Biomolecular Chemistry 3: pp. 3851. doi:.
- ↑ Iyer, R. P.; Beaucage, S. L. 7.05. Oligonucleotide synthesis. In: Comprehensive Natural Products Chemistry, Vol. 7: DNA and Aspects of Molecular Biology. Kool, Eric T.; Editor. Neth. (1999), 733 pp. Publisher: (Elsevier, Amsterdam, Neth.), 105–152.
- ↑ Michelson, A. M.; Todd, Alexander R. (1955). «Nucleotides part XXXII. Synthesis of a dithymidine dinucleotide containing a 3′: 5′-internucleotidic linkage». Journal of the Chemical Society (Resumed): pp. 2632. doi:.
- ↑ Hall, R. H.; Todd, Alexander; Webb, R. F. (1957). «644. Nucleotides. Part XLI. Mixed anhydrides as intermediates in the synthesis of dinucleoside phosphates». Journal of the Chemical Society (Resumed): pp. 3291. doi:.
- ↑ Froehler, B. C.; Ng, P. G.; Matteucci, M. D. (1986). «Synthesis of DNA via deoxynucleoside H-phosphonate intermediates». Nucleic Acids Res. 14 (13): pp. 5399–5407. doi:. PMID 3737406. PMC 311548. http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=311548.
- ↑ {{cita publicación |doi=10.1016/S0040-4039(00)84908-4 |título=Nucleoside H-phosphonates. III. Chemical synthesis of oligodeoxyribonucleotides by the hydrogenphosphonate approach |año=1986 |autor=Garegg, P |publicación=Tetrahedron Letters |volumen=27 |páginas=4051}
- ↑ Gilham, P. T.; Khorana, H. G. (1958). «Studies on Polynucleotides. I. A New and General Method for the Chemical Synthesis of the C5″-C3″ Internucleotidic Linkage. Syntheses of Deoxyribo-dinucleotides». Journal of the American Chemical Society 80: pp. 6212. doi:.
- ↑ Letsinger, R. L.; Ogilvie, Kelvin K. (1969). «Nucleotide chemistry. XIII. Synthesis of oligothymidylates via phosphotriester intermediates». Journal of the American Chemical Society 91: pp. 3350. doi:.
- ↑ Reese, C. (1978). «The chemical synthesis of oligo- and poly-nucleotides by the phosphotriester approach». Tetrahedron 34: pp. 3143. doi:.
- ↑ Efimov, V. A.; Buryakova, A. A.; Reverdatto, S. V.; Chakhmakhcheva, O. G.; Ovchinnikov, Yu. A. (1983). «Rapid synthesis of long-chain deoxyribooligonucleotides by the N-methylimidazolide phosphotriester method». Nucleic Acids Res 11 (23): pp. 8369–8387. doi:. PMID 6324083. PMC 326588. http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=326588.
- ↑ Efimov, V. A; Molchanova, N. S.; Chakhmakhcheva, O. G. (2007). «Approach to the synthesis of natural and modified oligonucleotides by the phosphotriester method using O-nucleophilic intramolecular catalysis.». Nucleosides, nucleotides & nucleic acids 26 (8-9): pp. 1087–93. doi:. ISSN 1525-7770. PMID 18058542.
- ↑ Letsinger, R. L.; Mahadevan, V (1966). «Stepwise synthesis of oligodeoxyribonucleotides on an insoluble polymer support.». Journal of the American Chemical Society 88 (22): pp. 5319. doi:. PMID 5979268.
Lecturas adicionales
- Comprehensive Natural Products Chemistry, Volume 7: DNA and Aspects of Molecular Biology. Kool, Eric T.; Editor. Neth. (1999), 733 pp. Publisher: (Elsevier, Amsterdam, Neth.)
- Beaucage, S. L.; Iyer, R. P. Advances in the synthesis of oligonucleotides by the phosphoramidite approach. Tetrahedron 1992, 48, 2223-2311.
- Beaucage, S. L.; Iyer, R. P. The functionalization of oligonucleotides via phosphoramidite derivatives. Tetrahedron 1993, 49, 1925-1963.
- Beaucage, S. L.; Iyer, R. P. The synthesis of modified oligonucleotides by the phosphoramidite approach and their applications. Tetrahedron 1993, 49, 6123-6194.
- Beaucage, S L. Oligodeoxyribonucleotides synthesis. Phosphoramidite approach. Methods in Molecular Biology (Totowa, NJ, United States) (1993), 20 (Protocols for Oligonucleotides and Analogs), 33-61.
- Reese, C. B. The chemical synthesis of oligo- and poly-nucleotides: a personal commentary. Tetrahedron 2002, 58, 8893-8920.
Commercialización
- Glaser, Vicki (1 de mayo de 2009). Oligo Market Benefits from RNAi Focus. Bioprocessing. 29. Mary Ann Liebert. 46–49. OCLC 77706455. http://www.genengnews.com/articles/chitem_print.aspx?aid=2894&chid=0. Consultado el 25 de julio de 2009.
Véase también
- Ácidos nucleicos
- Análogos de ácidos nucleicos
- Péptido de ácido nucleico
Wikimedia foundation. 2010.