- Reacción en cadena de la polimerasa
-
Reacción en cadena de la polimerasa
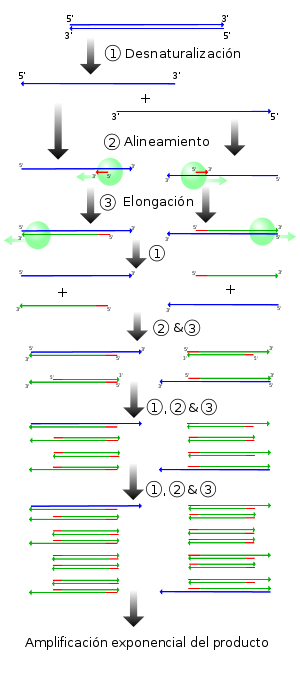
La reacción en cadena de la polimerasa, conocida como PCR por sus siglas en inglés (Polymerase Chain Reaction), es una técnica de biología molecular descrita en 1986 por Kary Mullis,[1] cuyo objetivo es obtener un gran número de copias de un fragmento de ADN particular, partiendo de un mínimo; en teoría basta partir de una única copia de ese fragmento original, o molde.
Esta técnica sirve para amplificar un fragmento de ADN; su utilidad es que, tras la amplificación, resulta mucho más fácil identificar con una muy alta probabilidad virus o bacterias causantes de una enfermedad, identificar personas (cadáveres) o hacer investigación científica sobre el ADN amplificado. Estos usos derivados de la amplificación han hecho que se convierta en una técnica muy extendida, con el consiguiente abaratamiento del equipo necesario para llevarla a cabo.
Contenido
Fundamento e importancia
Esta técnica se fundamenta en la propiedad natural de las ADN polimerasas para replicar hebras de ADN, para lo cual emplea ciclos de altas y bajas temperaturas alternadas para separar las hebras de ADN recién formadas entre sí tras cada fase de replicación y, a continuación, dejar que vuelvan a unirse a polimerasas para que vuelvan a duplicarlas. La reacción en cadena de la polimerasa fue desarrollada por Kary Mullis perteneciente a la Cetus Corporation en California SA, en la década de 1980.
Inicialmente la técnica era lenta, ya que las polimerasas se desnaturalizaban al realizar los cambios de temperatura y era necesario agregar nuevas polimerasas en cada ciclo. Puesto que las temperaturas del ciclo (95 ºC en las fases de desnaturalización del ADN) suponen la inmediata desnaturalización de toda proteína, se emplean ADN polimerasas termoestables, extraídas de microorganismos adaptados a vivir a esas temperaturas, restrictivas para la mayoría de los seres vivos. Dichos microorganismos, generalmente arqueas, son: Thermus aquaticus (polimerasa Taq), Pyrococcus furiosus (Pfu), Thermococcus litoralis (Vent) y Thermus termophilus (Tth). Generalmente se emplean mezclas de polimerasas muy procesivas (Taq) con otras con corrección de errores (Pfu, Vent).
Hoy, todo el proceso de la PCR está automatizado mediante un aparato llamado termociclador, que permite calentar y enfriar los tubos de reacción para controlar la temperatura necesaria para cada etapa de la reacción (ver más abajo). Muchos termocicladores modernos hacen uso del efecto Peltier, que permite tanto calentar como enfriar los tubos simplemente invirtiendo la corriente eléctrica. Los tubos usados para PCR tienen una pared muy fina, lo que favorece una buena conductividad térmica, permitiendo que se alcance rápidamente el equilibrio térmico. Casi todos los termocicladores tienen un sistema que calienta la tapa de cierre con el fin de evitar la condensación sobre los tubos de reacción. Los termocicladores más antiguos que carecían de este sistema, solucionaban el problema de la condensación con una capa de aceite en la parte superior de la mezcla de reacción o con un poco de cera dentro de los tubos.
Por lo general, la PCR es una técnica común y normalmente indispensable en laboratorios de investigación médica y biológica para una gran variedad de aplicaciones. Entre ellas se incluyen la clonación de ADN para la secuenciación, la filogenia basada en ADN, el análisis funcional de genes, el diagnóstico de trastornos hereditarios, la identificación de huellas genéticas (usada en técnicas forenses y tests de paternidad) y la detección y diagnóstico de enfermedades infecciosas.
Reactivos
 Tubos de PCR que albergan la mezcla en un volumen total de 100 μL.
Tubos de PCR que albergan la mezcla en un volumen total de 100 μL.
Para realizar la técnica se necesitan:[2]
- Desoxinucleótidos trifosfato (dNTPs), el sustrato para polimerizar nuevo ADN.
- Dos cebadores (o primers), oligonucleótidos que son, cada uno, complementarios a una de las dos hebras del ADN. Son secuencias cortas, de entre seis y cuarenta nucleótidos, normalmente de 18 a 22, que son reconocidos por la polimerasa permitiendo iniciar la reacción. Deben estar situados enfrentados y a no mucha distancia. Delimitan la zona de ADN a amplificar.
- Iones divalentes. Se suele usar magnesio (Mg2+), agregado comúnmente como cloruro de magnesio (MgCl2), o algún otro catión divalente. También se puede emplear manganeso (Mn2+), para mutagénesis de ADN mediante PCR, ya que altas concentraciones de Mn2+ incrementan la tasa de error durante la síntesis de ADN. Actúan como cofactores de la polimerasa.
- Iones monovalentes, como el potasio.
- Una solución tampón (buffer) que mantiene el pH adecuado para el funcionamiento de la ADN polimerasa.
- ADN polimerasa o mezcla de distintas polimerasas con temperatura óptima alrededor de 70ºC (la más común es la Taq polimerasa).
- ADN molde, que contiene la región de ADN que se va a amplificar.
- Termociclador, el aparato que va a mantener la temperatura necesaria en cada una de las etapas que conforman un ciclo.
Ciclo de amplificación
El proceso de PCR por lo general consiste en una serie de 20 a 35 cambios repetidos de temperatura llamados ciclos; cada ciclo suele consistir en 2-3 pasos de temperaturas. La PCR común se realiza con ciclos que tienen tres pasos de temperatura. Los pasos de ciclos a menudo están precedidos por un choque térmico (llamado "hold") a alta temperatura (> 90°C), y seguido por otro hold al final del proceso para la extensión de producto final o el breve almacenaje. Las temperaturas usadas y el tiempo aplicado en cada ciclo dependen de gran variedad de parámetros. Éstos incluyen la enzima usada para la síntesis de ADN, la concentración de iones divalentes y dNTPs en la reacción, y la temperatura de unión de los cebadores.[2]
Inicialización
Este paso consiste en llevar la reacción hasta una temperatura de 94-96ºC (ó 98ºC si se está usando una polimerasa termoestable extrema), que se mantiene durante 1-9 minutos. Esto sólo es necesario para ADN polimerasas que requieran activación por calor.
Desnaturalización
En primer lugar, se desnaturaliza el ADN (se separan las dos hebras de las cuales está constituido). Este paso puede realizarse de diferentes modos, siendo el calentamiento (94-95ºC) de la muestra la forma más habitual. La temperatura a la cual se decide realizar la desnaturalización depende, por ejemplo, de la proporción de G+C que tenga la hebra, como también del largo de la misma. Otros métodos, raramente empleados en la técnica de la PCR, serían la adición de sales o agentes químicos capaces de realizar la desnaturalización.
Alineamiento/Unión del cebador
A continuación se producirá la hibridación del cebador, es decir, el cebador se unirá a su secuencia complementaria en el ADN molde. Para ello es necesario bajar la temperatura a 50-65ºC durante 20-40 segundos (según el caso), permitiendo así el alineamiento. Los puentes de hidrógeno estables entre las cadenas de ADN (unión ADN-ADN) sólo se forman cuando la secuencia del cebador es muy similar a la secuencia del ADN molde. La polimerasa une el híbrido de la cadena molde y el cebador, y empieza a sintetizar ADN. Los cebadores actuarán como límites de la región de la molécula que va a ser amplificada.
Extensión/Elongación de la cadena
Actúa la ADN polimerasa, tomando el ADN molde para sintetizar la cadena complementaria y partiendo del cebador como soporte inicial necesario para la síntesis de nuevo ADN. La polimerasa sintetiza una nueva hebra de ADN complementaria a la hebra molde añadiendo los dNTP's complementarios en dirección 5'→ 3', uniendo el grupo 5'- fosfato de los dNTPs con el grupo 3'- hidroxilo del final de la hebra de ADN creciente (la cual se extiende). La temperatura para este paso depende de la ADN polimerasa que usemos. Para la Taq polimerasa, la temperatura de máxima actividad está en 75-80°C (comúnmente 72°C). El tiempo de extensión depende tanto de la ADN polimerasa usada como de la longitud del fragmento de ADN que se va a amplificar. Hay una regla básica: en su temperatura óptima, la polimerasa de ADN polimerizará mil bases en un minuto.
Elongación Final
Etapa única que se lleva a cabo a una temperatura de 70-74°C durante 5-15 minutos tras el último ciclo de PCR. Con ella se asegura que cualquier ADN de cadena simple restante sea totalmente ampliado.
Conservación
Este paso se lleva a cabo a 4-15°C durante un tiempo indefinido para conservar la reacción a corto plazo.
La PCR normalmente se realiza con un volumen de reacción de 15-100 μL, en pequeños tubos de 0.2-0.5 mL que se colocan en el termociclador.
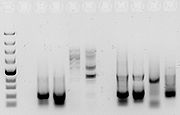
Para verificar que la PCR ha generado el fragmento de ADN previsto, se emplean técnicas de electroforesis, que separan los fragmentos de ADN generados de acuerdo a su carga, esto es, longitud, y, en menor medida y dependiendo de la matriz empleada, a su tamaño: típicamente se emplean la electroforesis en gel de agarosa, para fragmentos grandes; en acrilamida, para los más pequeños; y, de forma más rápida y aplicable a la PCR asociada a marcaje fluorescente, la electroforesis capilar.[3] El/los tamaño/s de los productos de la PCR vienen determinados por un marcador de peso molecular de ADN, el cual contiene fragmentos de ADN de tamaño conocido, y que se corre en el gel junto con los productos de PCR.
Optimización de la PCR
En la práctica, la PCR puede fallar por varias razones, pero normalmente es debido a su sensibilidad a la contaminación, que a veces provoca la amplificación de ADN "falso". Por esto, se han desarrollado un gran número de técnicas y procesos para optimizar la PCR:
- La contaminación con ADNs extraños puede solucionarse con protocolos y procedimientos que separen las reacciones pre-PCR de los contaminantes potenciales del ADN. Esto normalmente implica la separación espacial de las áreas de realización de la PCR de las de análisis o purificación de los productos de PCR, y la limpieza exhaustiva de la superficie de trabajo entre la realización de una PCR y la siguiente.
- Las técnicas de diseño de primers son importantes en la mejora de la obtención de productos de PCR y en evitar la formación de productos falsos, y el uso de componentes alternativos para los buffers o las enzimas polimerasas pueden ayudar en la amplificación de regiones de ADN largas o, de cualquier otra forma, problemáticas.
Tipos de PCR
PCR anidada
Técnica muy sensible de PCR en la que el producto de una amplificación es utilizado como molde para realizar una segunda amplificación con cebadores que se ubican dentro de la primera secuencia amplificada. Este tipo de PCR es muy específica.
PCR in situ
PCR realizada sobre preparaciones fijas sobre un portaobjetos. La PCR in situ consiste en una reacción de PCR en secciones histológicas o células, donde los productos generados pueden visualizarse en el sitio de amplificación. Es realizada sobre preparaciones fijas en un portaobjetos. En la técnica de PCR in situ se realiza una primera amplificación de ADN blanco y luego detección mediante hibridación in situ convencional con sondas de ADN/ARN. De esta manera pueden detectarse cantidades pequeñísimas de genoma. Esta tecnología es de gran alcance en la capacidad de amplificar específicamente una población de secuencias de menor representación.
PCR multiplex
PCR en la cual se amplifica más de una secuencia en una misma reacción. Emplea dos o más pares de cebadores en único tubo con el fin de amplificar simultáneamente múltiples segmentos de ADN. Consiste en combinar en una única reacción todos pares de cebadores de los sistemas que queremos amplificar simultáneamente, junto con el resto de los reactivos de la reacción en cantidades suficientes. Sus ventajas: se obtiene la información de varios loci en una sola reacción, menor cantidad de molde para el análisis, menor cantidad de reactivos, rápida construcción de base de datos.
PCR en Transcriptasa reversa (RT-PCR)
Donde el molde inicial es ARN y se requiere de una transcriptasa inversa, como Tth, para realizar la conversión del ARN a un tipo de ADN llamado ADNc (ADN complementario).
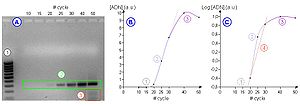
PCR tiempo real (Q-PCR)
Reacción de PCR cuya principal característica es que permite cuantificar la cantidad de ADN o ARN presentes en la muestra original, o para identificar con una muy alta probabilidad, muestras de DNA específicas a partir de su temperatura de fusión (también denominado valor Tm, del inglés melting temperature).
Se puede dividir en las técnicas basadas en fluorocromos no específicos y en técnicas basadas en sondas específicas.
En las técnicas basadas en fluorocromos, el ADN, que ve multiplicada su cantidad con cada ciclo se une al fluorocromo (generalmente SYBR Green) produciendo fluorescencia que es medida por el termociclador apto para RealTime PCR. Permite cuantificar sólo una secuencia por reacción pero tiene la ventaja de utilizar primers normales para su realización. Es mucho más económica que la realización de Realtime PCR con sondas específicas.
Las técnicas basadas en sondas específicas utilizan una sonda unida a dos fluorocromos que hibrida en la zona intermedia entre el cebador directo (forward) y el inverso (reverse), cuando la sonda está intacta, presentan una transferencia energética de fluorescencia por resonancia (FRET). Dicha FRET no se produce cuando la sonda está dañada y los dos fluorocromos están distantes, producto de la actividad 5'-3' exonucleasa de la ADN polimerasa. Esto permite monitorizar el cambio del patrón de fluorescencia y deducir el nivel de amplificación del gen.
La mayoría de estos inconvenientes se han solucionado con la introducción de la PCR realizada en tiempo real (Q-PCR), que elimina cualquier proceso post-PCR puesto que monitoriza la progresión de la amplificación en el momento en que ocurre. A diferencia de la PCR convencional (en punto final), que mide la acumulación ADN al final de un número predeterminado de ciclos, con Q-PCR esto se hace durante el proceso de amplificación usando fluorescencia, de forma que su aumento es proporcional a la cantidad de ADN formada. El proceso se puede automatizar fácilmente usando un sistema que realice la amplificación (termociclador) y que a su vez sea capaz de leer fluorescencia. Existe una amplia oferta de aparatos en el mercado. La mayoría pueden trabajar con las diversas opciones de marcado fluorescente y son "abiertos", es decir, permiten programar las condiciones de amplificación y lectura de forma que su uso no queda limitado a unos reactivos determinados. ADN complementario
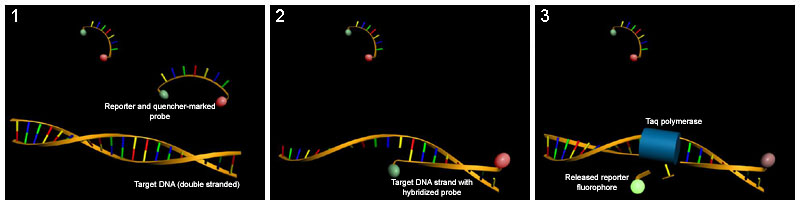
Variaciones de la PCR básica
- PCR específica de alelo: esta técnica de diagnóstico o clonación es usada para identificar o utilizar los polimorfismos de una sola base (SNPs).
- PCR "assembly": consiste en la síntesis artificial de largas secuencias de ADN, realizando para ello la PCR en un fondo de oligonucleótidos largos con secuencias solapantes cortas.
- PCR asimétrica: es usada para amplificar preferentemente una cadena del ADN original con respecto a la otra.
- PCR de colonia: mediante esta técnica, colonias de bacterias Escherichia coli pueden ser rápidamente examinadas para construcciones viables de vectores de ADN.
- Amplificación dependiente de helicasa: esta técnica es muy parecida a la PCR convencional, pero en ella se emplea la enzima helicasa y una temperatura constante en lugar de la polimerasa de ADN y los ciclos repetidos de desnaturalización-extensión.
- PCR hot-start: esta técnica reduce la amplificación inespecífica durante las etapas iniciales de la PCR.
- PCR específica de intersecuencia (ISSR): se trata de un método de PCR para su uso en huella genética, que amplifica regiones entre repeticiones de secuencia simple para producir una huella genética única de longitudes de fragmento amplificadas.
- PCR inversa: es un método usado para poder realizar la PCR cuando sólo es conocida una secuencia interna. Muy útil en la identificación de secuencias que flanquean insertos genómicos.
- PCR mediada por ligación: este método usa pequeños linkers de ADN ligados al ADN de interés y múltiples primers hibridando estos linkers.
- PCR específica de metilación (MSP): se usa para detectar metilaciones en islas CpG de ADN genómico.
- Amplificación Múltiple Dependiente de Sonda (Multiplex Ligation-dependent Probe Amplification o MLPA): permite amplificar varias secuencias objetivo con un único par de primers, evitando así las limitaciones de resolución de la PCR multiplex.
- PCR cuantitativa: es usada para medir la cantidad de un producto de PCR (preferentemente en tiempo real).
- PCR-TAIL: la PCR termal de entrelazado asimétrico es usada para aislar una secuencia desconocida que flanquea una secuencia conocida.
- PCR touchdown: se trata de una variante de la PCR que se emplea cuando se desconoce la secuencia exacta de los extremos de la secuencia a amplificar, de modo que se asume que puede existir alguna base desapareada en el alineamiento cebador-secuencia. Su finalidad es reducir el fondo no específico bajando gradualmente la temperatura de hibridación a lo largo del progreso de la PCR.
- PAN-AC: este método usa condiciones isotermas para la amplificación, y puede ser usado en células vivas.
Aplicaciones
La técnica de la PCR tiene multitud de aplicaciones: ya en ciencia básica, como herramienta de detección y/o generación de acervos de fragmentos de ADN de interés; ya en ciencia aplicada, como elemento resolutivo en sí mismo, por ejemplo en diagnóstico clínico.
Investigación
La PCR convencional se emplea como base para multitud de técnicas en el laboratorio debido a su robustez y rapidez. De este modo, la PCR de punto final permite controlar y detectar los fragmentos de ADN de interés.
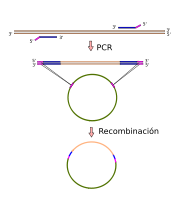
Una aplicación de la PCR de extrema importancia es la clonación de secuencias de ADN en vectores, como pueden ser los plásmidos. Para ello, se emplean cebadores que contienen en su extremo 5' una corta secuencia que permite la interacción posterior con otra complementaria situada en el vector de clonación a emplear. Por ejemplo, se puede incluir una diana de restricción en dichos cebadores, de modo que, y si ésta no existía previamente en el fragmento y es única en el vector, pueda efectuarse una ligación mediante la ligasa de T4 tras la digestión con la enzima de restricción apropiada de ambos elementos. Otro método asimilable a esta vía es el empleo de la recombinación dirigida; esto es, se adapta al 5' de los cebadores una secuencia que faculta a una recombinasa la recombinación dirigida con un vector dado.[4]
Medicina
En medicina, la PCR se emplea fundamentalmente como herramienta de diagnosis(Coleman y Tsongalis, 2006):
- Permite el genotipar la especie o especies que provocan un determinado cuadro infeccioso: para ello, se amplifica una zona del genoma bacteriano cuyo producto de PCR posea unas características de tamaño o temperatura de fusión que permitan identificarlo de forma inequívoca. En el caso de infecciones virales que implican la integración del genoma del patógeno en el ADN del hospedador, como es el de la infección por VIH, la PCR cuantitativa posibilita la determinación de la carga viral existente y por tanto, del estadio de la enfermedad.[5]
- La PCR también se puede usar en revisiones médicas rutinarias, como en los servicios de donantes de sangre, para test de rutina. A través de esta técnica se pueden detectar infecciones peligrosas en el donante (como VIH o Hepatitis B) mientras aún están en el periodo de incubación. Dada la sensibilidad de los test de PCR se pueden tomar muestras colectivas o "pools" (por ejemplo, 96 pruebas individuales). Si una de estas muestras colectivas da positivo, se toman a partir de ella muestras progresivamente menores hasta que se encuentra el causante.
- El diagnóstico de enfermedades hereditarias presentes en el genoma es un proceso largo y complicado que puede acortarse significativamente gracias a la PCR. Cada uno de los genes prueba se pueden amplificar mediante sus correspondientes primers y posteriormente secuenciar para detectar la existencia de mutaciones.
Paleontología, antropología biológica, y ciencias forenses
Los campos de la paleontología, antropología biológica y la medicina y antropología forense se han visto enormemente beneficiados por esta técnica, puesto que todas ellas construyen con frecuencia el conocimiento de sus correspondientes disciplinas gracias a restos o huellas de seres vivos. Uno de los materiales biológicos que más información puede proporcionar es el ADN.
La relativa estabilidad de éste permite que, aunque fragmentado, se conserve durante largos periodos de tiempo si las condiciones son propicias.[4] En ocasiones las muestras intactas con las que se puede contar son extraordinariamente pequeñas o están deterioradas. La PCR soluciona ambos problemas y proporciona cantidades útiles para posteriores pasos de análisis. En primer lugar aumenta la cantidad de material recuperado a partir de muestras escasas, puesto que como ya se dijo anteriormente, en teoría basta una sola molécula para que el proceso pueda tener lugar. También debido a la naturaleza de la técnica y su propósito de amplificación de fragmentos pequeños, esta fragmentación no impide que este ADN pueda ser empleado como molde para una reacción de PCR.- En paleontología y Antropología la PCR permite recuperar las escasas cantidades de ADN que aún no se han degradado. Algunos lugares en que el ADN podría preservarse son la brea las cenizas volcánicas, el ámbar, hielos históricos polares o glaciares y ambientes áridos, sedimentos, así como en los cristales de apatita de restos de esqueleto,[6] siendo posible de ese modo caracterizar cadáveres, fósiles u otros restos mediante genotipado por análisis de microsatélites o incluso genomas de taxones extintos, amplificados de este modo, como pueden ser los realizados mediante el ADN genómico del hombre de Neanderthal.[7] El propósito sería utilizar este ADN amplificado para posteriormente realizar estudios filogenéticos o etnográficos o de poblaciones mediante la comparación de secuencias de ADN, o el estudio de las causas de la separación evolutiva de dos especies.
- En las ciencias forenses se emplea para establecer la filiación de una persona o para obtener pruebas a partir de muestras mínimas dejadas por el autor de un crimen como saliva, semen u otros restos de tejidos (Butler, 2005).
Agronomía y diversidad
Tal y como la PCR multiplex permite producir huellas genéticas de individuos concretos, dentro del marco de la genética forense, existen métodos basados en la PCR que permiten discernir entre grupos infraespecíficos de cultivos de interés agronómico; por ejemplo, de cultivares.[8] Para ello, se emplean oligonucleótidos de un tamaño lo suficientemente pequeño como para que ceben de forma relativamente inespecífica, aunque siempre de tal forma que produzcan un patrón de bandas discreto e interpretable. De este modo, la pauta obtenida tras la electroforesis de los fragmentos tiende a agrupar a los individuos de mayor semejanza, que poseen un comportamiento similar, de los que divergen...
Historia
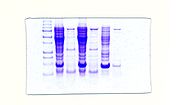
Electroforesis de proteínas SDS-PAGE resolviendo la Taq polimerasa.
En 1971, un artículo publicado por Kleppe et al. en Journal of Molecular Biology describió por primera vez un método que usaba enzimas para replicar una secuencia pequeña de ADN con primers in vitro.[9] Sin embargo, este temprano ejemplo del principio básico de la PCR no recibió mucha atención, y la invención de la reacción en cadena de la polimerasa en 1983 es generalmente atribuida a Kary Mullis.[10] [11] Mullis ganó el Premio Nobel por su trabajo en PCR.
Algo muy a tener en cuenta en la PCR es que la ADN polimerasa que se use sea capaz de soportar las altas temperaturas de >90ºC necesarias para la separación de las dos hebras de ADN de la doble hélice tras cada ciclo de replicación. Las ADN polimerasas que se utilizaron originariamente para los experimentos in vitro previos a la PCR no eran capaces de soportar estas altas temperaturas, por lo que los primeros procedimientos para replicar el ADN eran muy ineficientes, largos y requerían grandes cantidades de ADN polimerasa.
El descubrimiento en 1976 de la Taq polimerasa, una polimerasa de ADN extraída de la bacteria termófila Thermus aquaticus que habita medios de muy alta temperatura (50-80ºC), eliminó los grandes inconvenientes del método de la PCR. Esta ADN polimerasa es estable a altas temperaturas, permaneciendo activa hasta después de la desnaturalización del ADN, eliminando la necesidad de añadir a la reacción nueva polimerasa tras cada ciclo. Este descubrimiento permitió automatizar el proceso, antes tan tedioso, acoplándolo al uso del termociclador.
Al mismo tiempo que desarrollaba la PCR en 1983, Mullis trabajaba en Emeryville, California (EE UU), para una de las primeras empresas biotecnológicas, Cetus Corporation, donde era responsable de sintetizar cadenas cortas de ADN. Mullis afirma que concibió la idea para la PCR una noche mientras cruzaba la Autopista de la Costa Pacífica (EE UU) en su coche.[10] Estaba imaginando una nueva forma de analizar mutaciones en el ADN cuando se percató de que, en lugar de eso, había inventado un método para amplificar regiones específicas de ADN mediente ciclos de duplicación repetidos usando ADN polimerasas. Mullis atribuye la invención de esta técnica a los efectos de la droga psicodélica y alucinógena LSD.[12]
En la revista Scientific American, Mullis resumió el procedimiento: "Comenzando con una única molécula del material genético ADN, la PCR puede generar 100 billones de moléculas iguales en una tarde. La reacción es fácil de hacer, no requiere más que un tubo de pruebas, unos pocos reactivos simples y una fuente de calor."[13] Fue premiado con el Premio Nobel de Química en 1993 por su invención, y siete años después, él y sus colegas del Cetus llevaron a la práctica su propuesta. Sin embargo, han aparecido controversias y diferentes versiones sobre las contribuciones intelectuales y prácticas de otros científicos al trabajo de Mullis, y sobre si él fue el inventor único del principio de la PCR.
Guerras de patentes
La técnica de la PCR fue patentada por Cetus Corporation, donde Mullis trabajaba cuando inventó la técnica en 1983. La enzima Taq polimerasa fue también cubierta de patentes. Tuvieron lugar varios pleitos relacionados con la técnica, incluyendo un pleito fracasado generado por DuPont. La compañía farmacéutica Hoffmann-La Roche adquirió los derechos de las patentes en 1992 y actualmente mantiene las que aún están protegidas.[14] [15]
Referencias
Citadas en el texto
- ↑ Bartlett & Stirling (2003)—A Short History of the Polymerase Chain Reaction. In: Methods Mol Biol. 226:3-6
- ↑ a b Joseph Sambrook and David W. Russel (2001). Molecular Cloning: A Laboratory Manual, 3rd ed. edición, Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory Press. ISBN 0-87969-576-5.
- ↑ Mathews, C. K.; Van Holde, K.E et Ahern, K.G (2003). «6», Bioquímica, 3 edición, pp. 204 y ss. ISBN 84-7892-053-2.
- ↑ a b Watson, J, D.; Baker, T. A.; Bell, S. P.; Gann, A.; Levine, M. et Losick, R (2004). Molecular Biology of the Gene, Fifth edition edición, San Francisco: Benjamin Cummings. ISBN 0-321-22368-3.
- ↑ Scott L. Butler, Mark S.T. Hansen & Frederic D. Bushman (2007). «A quantitative assay for HIV DNA integration in vivo» Nature Medicine. n.º 7. pp. 631-634. doi:10.1038/87979.
- ↑ Museo Victora de Melbourne sobre la preservación del ADN
- ↑ James P. Noonan,Graham Coop, Sridhar Kudaravalli, Doug Smith, Johannes Krause, Joe Alessi, Feng Chen, Darren Platt, Svante Pääbo, Jonathan K. Pritchard, Edward M. Rubin (17 de noviembre de 2006). «Sequencing and Analysis of Neanderthal Genomic DNA» Nature Medicine. Vol. 314. n.º 5802. pp. 1113 - 1118. DOI: 10.1126/science.1131412.
- ↑ Jinguo Hu1 and Carlos F. Quiros (1991). «Identification of broccoli and cauliflower cultivars with RAPD markers» Plant Cell Reports. Vol. 10. n.º 10. DOI: 10.1007/BF00234583.
- ↑ Kleppe K, Ohtsuka E, Kleppe R, Molineux I, Khorana HG (1971). «Studies on polynucleotides. XCVI. Repair replications of short synthetic DNA's as catalyzed by DNA polymerases» J. Mol. Biol.. Vol. 56. pp. 341-361.
- ↑ a b Mullis, Kary (1998). Dancing Naked in the Mind Field. New York: Pantheon Books. ISBN 0-679-44255-3.
- ↑ Rabinow, Paul (1996). Making PCR: A Story of Biotechnology. Chicago: University of Chicago Press. ISBN 0-226-70146-8.
- ↑ Mullis, Kary (1998). Dancing Naked in the Mind Field. New York: Pantheon Books, pp. 18. ISBN 0-679-44255-3.
- ↑ Mullis, Kary (1990). «The unusual origin of the polymerase chain reaction» Scientific American. Vol. 262. n.º 4. pp. 56-61, 64-5.
- ↑ PR Newswire
- ↑ Consejos sobre como sobrevivir a la guerra de las patentes de Taqs: GEN Genetic Engineering News Biobusiness Channel: Artículos. 1 de mayo de 2006 (Vol. 26, No. 9).
Referencias generales
- Saiki RK, Gelfand DH, Stoffel S, Scharf SJ, Higuchi R, Horn GT, Mullis KB, et al.(1988) Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase. Science 239: 487–491
- Griffiths, J.F. A. et al. (2002). Genética. McGraw-Hill Interamericana. ISBN 84-486-0368-0.
- Coleman, WB y Tsongalis, GJ (2006). Molecular Diagnostics: For the Clinical Laboratorian. Humana Press. ISBN 1-58829-356-4.pgs. 47-56 y 65-74
- Butler, JM (2005). Forensic DNA Typing: Biology, Technology, and Genetics of STR. Academic Press pgs 63-84. ISBN 0-12-147952-8.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Reacción en cadena de la polimerasa.Commons
Wikimedia Commons alberga contenido multimedia sobre Reacción en cadena de la polimerasa.Commons- Animación PCR
- Nueva técnica más eficiente en PCR
- Please find all details about real-time PCR here: http://www.gene-quantification.info - The reference in real-time PCR
- Simulation online de reacciones de PCR frente a procariotas secuenciados.
- Ejercicio online en el que se diseñan y simulan experimentos de PCR y PCR-RFLP.
Categorías: Genética | Técnicas analíticas en biología molecular
Wikimedia foundation. 2010.