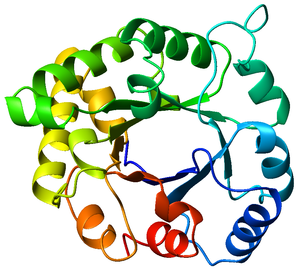
- Barril TIM
-
Barril TIM
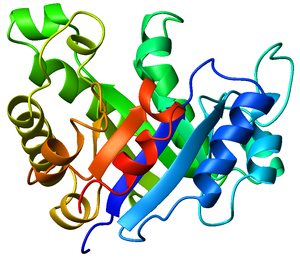
 Vista superior del barril TIM de la triosa fosfato isomerasa (código PDB 8TIM), coloreado desde el azul (N-terminal) al rojo (C-terminal).
Vista superior del barril TIM de la triosa fosfato isomerasa (código PDB 8TIM), coloreado desde el azul (N-terminal) al rojo (C-terminal).
El barril TIM es un motivo estructural de proteínas muy conservado que consiste en ocho hélices alfa y ocho láminas beta paralelas que se alternan en el esqueleto de la proteína. La estructura debe su nombre a la triosa fosfato isomerasa, una enzima glucolítica muy conservada. Posteriormente se descubrió que los barriles TIM son bastante comunes entre los plegamientos de proteínas conservados.
Contenido
Estructura y composición
Los barriles TIM son considerados plegamientos α/β, debido a que incluyen un modelo de alternancia de hélices alfa y láminas beta en un único dominio. En un barril TIM las hélices y láminas (por lo general, ocho de cada uno) forman un solenoide que se curva para cerrarse sobre si mismo en forma de toroide. Las láminas beta paralelas forman la pared interior del toroide, que le dan su forma de barril, mientras que las hélices alfa forman la pared exterior. Cada lámina beta se conecta con la adyacente en el barril a través de un largo bucle, que incluye una de las hélices. El barril TIM también puede ser pensado, como formada por la superposición de ocho estructuras supersecundarias β-α-β en en sentido horario.[1]
Cabe destacar que, aunque el diagrama de cintas muestra un hueco en el núcleo central, las cadenas laterales de aminoácidos no se muestran en esta representación. El núcleo de la proteína está en realidad ajustadamente empaquetado, en gran medida con residuos aminoácidos hidrofóbicos voluminosos, aunque unas pocas glicinas son necesarias para permitir cierto espacio para un limitado desplazamiento en el centro donde encajan las ocho repeticiones. Las interacciones de empaquetamientro entre las láminas y las hélices está también dominadas por la hidrofobicidad y y las ramificaciones de los residuos alifáticos de valina, leucina, isoleucina que conforman alrededor del 40% del total de residuos en las láminas beta.[1]
Regiones bucle
De los aproximadamente 200 residuos requeridos para poder formar un barril TIM, unos 160 son considerados estructuralmente equivalentes entre diferentes proteínas que comparten este tipo de plegamiento. El resto de residuos se encuentran en el bucle de las regiones que vinculan las hélices y las láminas; los bucles en el extremo C-terminal de las láminas beta suelen contener el sitio activo, lo cual es una de las razones de este tipo de plegamiento sea tan común: los residuos necesarios para mantener la estructura y los residuos que llevan a cabo la catálisis enzimática se encuentran en diferentes subconjuntos. La bucles enlazantes pueden ser tan largos que incluso pueden contener otros dominios de proteínas.
Referencias
Lecturas complementarias
- R. K. Wierenga (2001). «The TIM-barrel fold: a versatile framework for efficient enzymes» FEBS Lett.. Vol. 492. n.º 3. pp. 192–198. DOI 10.1016/S0014-5793(01)02236-0.
Enlaces externos
Categoría: Estructura de las proteínas
Wikimedia foundation. 2010.