- Ácido malónico
-
Ácido malónico 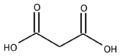
Nombre IUPAC Ácido propanodioico Otros nombres Ácido carboxiacético,
Dicarboximetano,
Ácido metanodicarbónicoFórmula empírica C3H4O4 Masa molecular 104,06 g/mol Estado físico/Color Cristales blancos Número CAS 141-82-2 Propiedades Densidad 1,619 g/cm3 a 25 °C Punto de fusión 135-136°C (408-409 K) Punto de ebullición Descompone Solubilidad en agua 1390 g/l a 22 °C pKa1 en agua 2,83 a 25 °C pKa2 en agua 5,69 a 25 °C Información de Seguridad 
Frases R: R22, R36 Frases S: S22, S24
Exenciones y Referencias[1] [2] [3] El ácido malónico (nombre IUPAC: ácido propanodioico) es un ácido dicarbóxilico con estructura CH2(COOH)2. A la forma ionizada del ácido malónico así como a sus ésteres y sales se les conoce como malonatos.
Su nombre deriva de la palabra latina malum que significa manzana.
Contenido
Bioquímica
Un derivado del ácido malónico, el malonil-CoA, es el precursor de la biosíntesis de ácidos grasos.
El ácido malónico inhibe a la succinato deshidrogenasa en el ciclo del ácido cítrico.
La sal cálcica del ácido malónico se encuentra en la raíz de remolacha.
Síntesis
Una preparación clásica[4] del ácido malónico parte del ácido ácetico. Este ácido es clorado a ácido cloroacético. A continuación con carbonato sódico se genera la sal sódica. Ésta se hace reaccionar con cianuro sódico obteniendo el cianoacetato a través de una sustitución nucleófila donde el CN- reemplaza al átomo de cloro. El grupo ciano puede ser hidrolizado con sosa a carboxílico. El malonato de sodio resultante mediante acidificación conduce al ácido malónico.
Aplicaciones
En una reacción bien conocida el ácido malónico condensa con la urea para dar ácido barbitúrico.
Sus ésteres, y en particular habitualmente el malonato de etilo, son comúnmente usados para llevar a cabo reacciones de síntesis malónica.
Referencias
- ↑ Fichas internacionales de seguridad química (FISQ)
- ↑ Fichas de datos de seguridad (FDS)
- ↑ R.E. Dickerson, H.B. Gray, M.Y. Darensburg, D.J. Darensburg (1992), Principios de Química, Barcelona: EDITORIAL REVERTÉ S.A., página 175 (Tabla de constantes de disociación ácida)
- ↑ Organic Syntheses, Coll. Vol. 2, p.376 (1943); Vol. 18, p.50 (1938).Artículo en inglés
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A.. ISBN 84-282-0882-4.
- W.R. Peterson (1996). Formulación y nomenclatura química orgánica. Barcelona: EDUNSA - Ediciones y distribuciones universitarias S.A.. ISBN 84-85257-03-0.
Enlaces externos
Categoría:- Ácidos dicarboxílicos
Wikimedia foundation. 2010.
