- Aconitasa
-
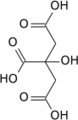
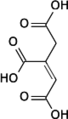
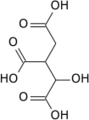
Aconitasa 1, soluble HUGO 117 Símbolo ACO1 Símbolos alt. IREB1 Datos genéticos Código de gen ACO1 Tipo de gen Gen codificante Locus Cr. 9 p21.1 Estructura/Función proteica Tamaño 889 (aminoácidos) Bases de datos Número EC 4.2.1.3 Entrez 48 OMIM 100880 RefSeq NM_002197 UniProt P21399 Aconitasa 2, mitocondrial HUGO 118 Símbolo ACO2 Datos genéticos Código de gen ACO2 Tipo de gen Gen codificante Locus Cr. 22 q13.2 Estructura/Función proteica Tamaño 780 (aminoácidos) Bases de datos Número EC 4.2.1.3 Entrez 50 OMIM 100850 RefSeq NM_001098 UniProt Q99798 La aconitasa o aconitato hidratasa (EC 4.2.1.3) es un enzima que cataliza la isomerización estereoespecífica de citrato a isocitrato a través de cis-aconitato en el ciclo de Krebs.
Función
Al contrario que la mayoría de las proteínas hierro-azufre, que funcionan como transportadores de electrones, el centro hierro-azufre de la aconitasa reacciona directamente con el sustrato de una enzima. La aconitasa tiene un centro activo [Fe4S4]2+, que puede convertirse a una forma inactiva [Fe3S4]+. Se ha demostrado que tres residuos de cisteína (Cys) son ligandos del centro [Fe4S4]. En estado activo, los lábiles iones de hierro del centro [Fe4S4] no están coordinados por Cys, sino por moléculas de agua.
Son homólogos de la aconitasa la proteína que une el elemento regulador de hierro (IRE-BP) y la 3-isopropilmalato deshidratasa (α-isopropilmalato isomerasa, una enzima que cataliza el segundo paso de la biosíntesis de leucina). Los elementos reguladores de hierro (IRES) constituyen una familia de secuencias de 28 nucleótidos, no codificantes, que forman estructuras de tallo y bucle que regulan el almacenamiento de hierro, la síntesis de hemo y la absorción de hierro.
También participan en la unión a ribosomas y el control del ARNm (degradación). La proteína reguladora específica, el IRE-BP, se une a IREs en las regiones 5' y 3', pero sólo en el ARN en la forma apo, sin el centro hierro-azufre. La expresión de IRE-BP en los cultivos celulares ha revelado que la proteína funciona tanto como una aconitasa activa, cuando las células están repletas de hierro-, o como un proteína activa de unión a ARN, cuando las células carecen de hierro. Las IRE-BP mutantes, en donde todos o alguno de los tres residuos de cisteína que participan en la formación de Fe-S se sustituyen por serina, la aconitasa pierde su actividad, pero conserva sus propiedades de unión a ARN.
La aconitasa es inhibida por fluoroacetato, razón por la que éste es venenoso. El centro hierro-azufre es muy sensible a la oxidación por superóxido.[1]
Referencias
- ↑ Aconitase: sensitive target and measure of superoxide. Methods Enzymol, 2002. 349: p. 9-23.
- Beinert, H., Kennedy, M.C. and Stout, C.D. (1996). «Aconitase as iron-sulfur protein, enzyme, and iron-regulatory protein». Chem. Rev. 96: pp. 2335–2373. doi:.
- Flint, D.H. and Allen, R.M. (1996). «Iron-sulfur proteins with nonredox functions». Chem. Rev. 96: pp. 2315–2334. doi:.
- Frishman, D. and Hentze, M.W. (1996). «Conservation of aconitase residues revealed by multiple sequence analysis». Eur. J. Biochem. 239: pp. 197–200. doi:.
Enlaces externos
Categorías:- Genes del cromosoma 9
- Genes del cromosoma 22
- Liasas
Wikimedia foundation. 2010.