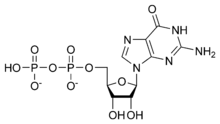
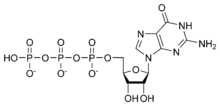
- Proteína G
-
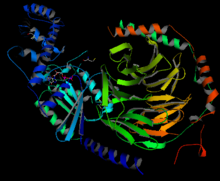 Proteína G heterotrimérica mostrando en azul la subunidad αt/αi y en rojo y verde la βγ.[1]
Proteína G heterotrimérica mostrando en azul la subunidad αt/αi y en rojo y verde la βγ.[1]
Las proteínas G son transductores de señales que llevan información (p. ej., el enlace con agonistas) desde el receptor hasta una o más proteínas efectoras. Existe una gran superfamilia de receptores para numerosos fármacos destinatarios que interactúan con ciertas proteínas reguladoras heterotriméricas ligadas a GTP conocidas como proteínas G. Los receptores acoplados a la proteína G (G protein-coupled receptors, GPCR) comprenden a los de varias aminas biógenas, eicosanoides y otras moléculas que envían señales a lípidos, péptidos hormonales, opiáceos, aminoácidos como GABA y muchos otros péptidos y ligandos proteínicos. Los efectores que son regulados por la proteína G comprenden enzimas como la adenililciclasa, fosfolipasa C, fosfodiesterasas y canales de iones de la membrana plasmática selectivos para Ca2+ y K+. Gracias a su número e importancia fisiológica, los GPCR constituyen objetivos muy utilizados para los fármacos; quizás la mitad de los fármacos que no son antibióticos están dirigidos hacia estos receptores, que constituyen la tercera familia más grande de genes en el ser humano.
Forman una familia de proteínas caracterizadas por su interacción con guanosín trifosfato (GTP) conducente a la hidrólisis del nucleótido a guanosín difosfato (GDP). Su nombre deriva la inicial de guanosina, por tanto. En la fisiología celular actúan como interruptores biológicos mediante la transducción de señales. De esta manera, un estímulo del exterior celular, un ligando por ejemplo, accede al receptor celular asociado a proteína G o GPCR desencadenado una cascada de actividades enzimáticas o segundos mensajeros como respuesta.[2]
Debido a su estructura molecular, las proteínas G se clasifican en dos tipos, heterotriméricas y monoméricas. Las primeras, grandes o heterotriméricas, están constituidas por tres subunidades distintas, denominadas αβγ; se trata de proteínas ancladas a membrana, aunque no integrales de membrana. Las segundas, pequeñas o monoméricas, con una única subunidad, se encuentran libres en el citosol y nucleoplasma.[3]
Estas proteínas se encuentran activadas cuando poseen GTP en su estructura, e inactivadas cuando se trata de GDP. Por tanto, la actividad GTPasa es crucial para su funcionamiento como interruptores biológicos. Dicha actividad hidrolítica se modula también mediante proteínas accesorias, como son las pertenecientes a los siguientes grupos:[4]
- GEF, de las siglas en inglés de factor intercambiador de nucleótido de guanina. Se trata de un factor proteico que facilita el intercambio de GDP de la estructura de la proteína G por GTP, por lo cual la activa.
- GAP, de las siglas en inglés de proteína aceleradora de la actividad GTPasa, que favorece la ruptura del enlace fosfodiéster del GTP a GDP, por lo cual inactiva a la proteína G.
Estos reguladores, denominados a veces en la literatura como RGS (de las siglas en inglés regulator of G protein signaling), modifican la actividad hidrolítica de las proteínas G mediante mecanismos moleculares que han sido descritos en algunos casos, puesto que hay decenas de reguladores identificados. De hecho, se cree que proteínas reguladoras concretas, expresadas en células específicas en momentos definidos, tienen un papel importante en la modulación de la transducción de señales.[4]
Es de resaltar que GAP sólo aumenta la velocidad de la actividad GTPasa; el punto clave de la regulación mediada por proteínas G consiste en su tenencia de una actividad GTPasa que proporcione un lapso de actividad corto y definido. La activación permanente de la proteína G es muy perniciosa y, de hecho, es causa de enfermedades (por ejemplo, algunos cánceres,[5] o bien la deshidratación por la toxina del vibrio del cólera).[6]
Contenido
Proteínas G heterotriméricas
Las proteínas G grandes, o heterotriméricas, se sitúan en la membrana plasmática, a la cual están ligadas por sus subunidades α y γ mediante estructuras hidrofóbicas, de tipo ácido graso o isoprenoide. Queda una tercera subunidad, la β, que se asocia a la subunidad γ. En conjunto, y en reposo, es decir, con GDP unido a la subunidad α, las tres subunidades se sitúan en algún lugar de la membrana biológica, poseyendo movimiento dada su fluidez. Cuando un GPCR recibe un estímulo y se activa a la proteína G, con la consiguiente adquisición de GTP, hidrolizado tras un lapso después, ésta se disgrega en dos partes: una, βγ, que puede ejercer funciones biológicas como la apertura de canales; y otra, α, que activa cascadas de señalización celular, como por ejemplo mediante adenilato ciclasa y la generación de AMP cíclico.
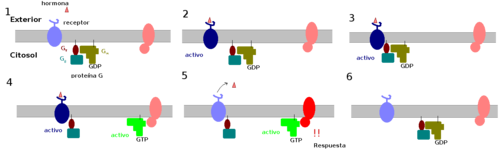
El proceso de activación de proteínas efectoras inducidas por ligando puede explicarse según un modelo en tres fases:[2] [3]
- El receptor (azul claro) se encuentra en estado de reposo, así como el efector (rojo pálido). La proteína G se encuentra con todas sus subunidades asociadas y con GDP; por lo tanto, inactiva.
- La unión de la hormona induce un cambio conformacional en el receptor, que se activa (azul oscuro).
- El receptor activado se une a la subunidad Gβγ.
- A consecuencia de dicha interacción, Gα cambia su conformación, se disocia el GDP y se adopta GTP, por lo que la proteína se encuentra activa. Gα se desplaza separándose del resto de subunidades aprovechando su independencia derivada de la posesión de anclas en la bicapa lipídica.
- La hormona se disocia del receptor, por lo cual se inactiva (azul claro). Gα se une al efector y lo activa (rojo). El efector realiza una actividad catalítica.
- La hidrólisis de GTP a GDP causa la disociación de Gα del efector y se reasocia con Gβγ. Todo el sistema queda en reposo, inactivo.
La activación catalítica de las proteínas G heterotriméricas mediada por la interacción con los receptores (GPCRs) puede interpretarse como una actividad de factor intercambiador de nucleótidos de guanina de estos últimos. La comunicación estructural entre la subunidad βγ de la proteína G y el receptor es motivo de interés en la comunidad científica puesto que algunos de estos receptores son el objetivo de nuevas drogas para combatir enfermedades;[7] además, dichos receptores son abundantes en el genoma (representando más del 1 % del humano[8] ), y están involucrados en funciones tanto cardiovasculares, como nerviosas, endocrinas y sensoriales.[9] [10] [11]
Proteínas G monoméricas
Las proteínas G monoméricas o pequeñas son GTPasas de masas moleculares entre 20 y 40 kDa.[12] Actúan como reguladoras de procesos claves, como la proliferación celular (p. ej. Ras), tráfico de vesículas (p. ej. Rab) o la estructura del citoesqueleto (p. ej. Rho). Aúnan en el mismo polipéptido la actividad GTPasa y la capacidad reconocimiento de motivos estructurales en otras moléculas, siendo además muy móviles en el interior celular, sin poseer la restricción de su ligación a las membranas celulares. Para regular su actividad GTPasa, existen también proteínas GEF y GAP, antes mencionadas. En muchos casos, se encuentran solubles en el citosol, puesto que, aunque albergan en su estructura una cadena hidrofóbica que les permite anclarse a las membranas, la mantienen escondida hasta que un estímulo les sugiere un cambio conformacional para exponerla. Así, existe una dicotomía entre posesión de GDP o GTP pero también de exposición o salvaguardia de la cadena hidrofóbica.[2] [3] Sus primeros representantes, Ha-Ras y Ki-Ras, fueron descubiertos como oncogones de virus de sarcoma (v-Ha-Ras y v-Ki-Ras) a finales de los años 70.[13] [14] Durante los años siguientes, se describieron centenares de miembros de la superfamilia en todo tipo de eucariotas, desde levaduras a humanos.[12]
Estructuralmente, los análisis de cristalografía y resonancia magnética nuclear efectuados sobre distintos representantes de la superfamilia determinaron la existencia de dominios de unión a nucleótidos de guanina con una topología común. Mediante el estudio de moléculas tanto unidas a GDP como a GTP, y sus diferencias, se encontró que existen dos regiones flexibles en torno al carbono γ del GTP: una primera región «bisagra» entre los giros L2 y β2 (que determinan una región efectora) y una segunda entre los giros L4 y la hélice alfa 2. La región efectora giraría dando lugar a dos estados: el de interacción con GTP o GDP, mediante la interacción del fosfato situado en γ con la Tyr-32 de la proteína.[15]
Receptores y efectores
 Estructura esquemática mostrando los 7 dominios transmembrana.
Estructura esquemática mostrando los 7 dominios transmembrana.
Los receptores asociados a proteína G se reconocen por su estructura en serpentín, esto es, con siete dominios transmembrana, por lo que a veces son denominados «receptores 7TM». Comprenden multitud de proteínas, puesto que el término corresponde a una familia de receptores transmembrana que detectan señales extracelulares y las transmiten a las cascadas de transducción de señales del interior celular, que desencadenan a su vez las respuestas pertinentes (por ejemplo, la modulación de la transcripción genética. Están presentes en eucariotas, tanto en levaduras, coanoflagelados, plantas y animales.[16] Reconocen gran variedad de ligandos, como son los neurotransmisores, feromonas, hormonas, odorivectores, y gran variedad de péptidos y proteínas. Su disfunción ocasiona enfermedades, y se emplean como diana en quimioterapia.[17]
En cuanto a su estructura, los siete dominios transmembrana poseen dos características clave:[3]
- Orientación con el extremo amino terminal hacia el exterior y el carboxilo terminal hacia el interior.
- Estructura de siete alfa-hélices transmembrana (H1 a H7), cuatro segmentos extracelulares (E1 a E4) y cuatro segmentos citosólicos (C1 a C4). El segmento carboxiterminal, el tercer bucle citosólico (C3) y, a veces, también el segundo (C4) están implicados en la interacción con la proteína G.
De acuerdo a la homología de secuencia y similitud funcional, se clasifican en seis grandes grupos:[18] [19] [20] [21]
- Clase A (o 1) (receptores semejantes a rodopsina)
- Clase B (o 2) (receptores de de la familia secretina)
- Clase C (o 3) (receptor metabotrópico de glutamato)
- Clase D (o 4) (receptores fúngicos involucrados en la determinación sexual)
- Clase E (o 5) (receptores de AMPc)
- Clase F (o 6) (Frizzled/Smoothened, de las vías Wnt y hedgehog, respectivamente)
En cuanto a los efectores de las proteínas G, los de mamíferos pueden clasificarse de acuerdo a los siguientes grupos:[3]
Clase GΑ Efector asociado Segundo mensajero Ejemplos de receptores Gsα Adenilil ciclasa Aumento de AMPc β-adrenérgico, glucagón, serotonina, vasopresina Giα Adenililciclasa, canal de K+ Disminución AMPc, cambio en el potencial de membrana α2-adrenérgico, muscarínico de acetilcolina Golfα Adenilil ciclasa Aumento AMPc Olfatorios Gqα Fosfolipasa C Aumento IP3, DAG α1-adrenérgico Goα Fosfolipasa C Aumento IP3, DAG Acetilcolina de células endoteliales GtΑ cGMP fosfodiesterasa Disminución cGMP Rodopsina de las células bastón Véase también
- Ciclo celular
- Receptores en la Transcripción de Genes
Referencias
- ↑ Lambright, D.G. and Sondek, J. and Bohm, A. and Skiba, N.P. and Hamm, H.E. and Sigler, P.B. (1996). The 2.0 A crystal structure of a heterotrimeric G protein. Nature Publishing Group.
- ↑ a b c Alberts et al (2004). Biología molecular de la célula. Barcelona: Omega. ISBN 54-282-1351-8.
- ↑ a b c d e Lodish et al. (2005). Biología celular y molecular. Buenos Aires: Médica Panamericana. ISBN 950-06-1974-3.
- ↑ a b «The regulator of G protein signaling family», Annual Review of Pharmacology and Toxicology 40 (1): 235--271, http://medicina.iztacala.unam.mx/medicina/REGULADOR%20DE%20PROT%20G.pdf, consultado el 30 de julio de 2009
- ↑ Dammann, R. and Li, C. and Yoon, J.H. and Chin, P.L. and Bates, S. and Pfeifer, G.P. (2000). «Epigenetic inactivation of a RAS association domain family protein from the lung tumour suppressor locus 3p21. 3». Nature genetics (Nature Publishing Group) 25 (3): pp. 315--319.
- ↑ Herrington, DA and Hall, RH and Losonsky, G. and Mekalanos, JJ and Taylor, RK and Levine, MM (1988). «Toxin, toxin-coregulated pili, and the toxR regulon are essential for Vibrio cholerae pathogenesis in humans». Journal of Experimental Medicine 168 (4): pp. 1487--1492.
- ↑ Spiegel AM and Weinstein LS (2004) Inherited diseases involving G proteins and G protein-coupled receptors. Annu Rev Med 55: 27-39
- ↑ Takeda S, Kadowaki S, Haga T, Takaesu H, and Mitaku S (2002) Identification of G protein-coupled receptor genes from the human genome sequence. FEBS Lett 520: 97-101
- ↑ Rohrer DK and Kobilka BK (1998) G protein-coupled receptors: functional and mechanistic insights through altered gene expression. Physiol Rev 78: 35-52
- ↑ Yang AH, Ishii I, and Chun J (2002) In vivo roles of lysophospholipid receptors revealed by gene targeting studies in mice Biochim Biophys Acta 1582: 197-203
- ↑ Karasinska JM, George SR, and O'Dowd BF (2003) Family 1 G protein-coupled receptor function in the CNS. Insights from gene knockout mice. Brain Res Brain Res Rev 41: 125-152.
- ↑ a b Takai, Y. and Sasaki, T. and Matozaki, T. (2001). «Small GTP-binding proteins». Physiological reviews (Am Physiological Soc) 81 (1): pp. 153--208.
- ↑ Chien UH, Lai M, Shih TY, Verma IM, Scolnick EM, Roy-Burman P, and Davidson N. Heteroduplex analysis of the sequence relationships between the genomes of Kirsten and Harvey sarcoma viruses, their respective parental murine leukemia viruses, and the rat endogenous 30S RNA. J Virol 31: 752-760, 1979
- ↑ hih TY, Williams DR, Weeks MO, Maryak JM, Vass WC, and Scolnick EM. Comparison of the genomic organization of Kirsten and Harvey sarcoma viruses. J Virol 27: 45-55, 1978
- ↑ McCormick F, and Wittinghofer A. Interactions between Ras proteins and their effectors. Curr Opin Biotechnol 7: 449-456, 1996
- ↑ King N, Hittinger CT, Carroll SB (2003). «Evolution of key cell signaling and adhesion protein families predates animal origins». Science 301 (5631): pp. 361–3. doi:. PMID 12869759.
- ↑ Filmore, David (2004). «It's a GPCR world». Modern Drug Discovery (American Chemical Society) 2004 (November): pp. 24–28. http://pubs.acs.org/subscribe/journals/mdd/v07/i11/html/1104feature_filmore.html.
- ↑ Attwood TK, Findlay JB (1994). «Fingerprinting G-protein-coupled receptors». Protein Eng 7 (2): pp. 195–203. doi:. PMID 8170923. http://peds.oxfordjournals.org/cgi/reprint/7/2/195.
- ↑ Kolakowski LF Jr (1994). «GCRDb: a G-protein-coupled receptor database». Receptors Channels 2 (1): pp. 1–7. PMID 8081729.
- ↑ Foord SM, Bonner TI, Neubig RR, Rosser EM, Pin JP, Davenport AP, Spedding M, Harmar AJ (2005). «International Union of Pharmacology. XLVI. G protein-coupled receptor list». Pharmacol Rev 57 (2): pp. 279–88. doi:. PMID 15914470.
- ↑ InterPro
Categoría:- Proteínas G
Wikimedia foundation. 2010.