- Miosina
-
 Moléculas de miosina sufriendo un cambio conformacional en tiempo real. La imagen ha sido realizada mediante una técnica híbrida de AFM con microscopía de fluorescencia de reflexión total
Moléculas de miosina sufriendo un cambio conformacional en tiempo real. La imagen ha sido realizada mediante una técnica híbrida de AFM con microscopía de fluorescencia de reflexión total
La miosina es una proteína fibrosa, cuyos filamentos tienen una longitud de 1,5 µm y un diámetro de 15 nm, y está implicada en la contracción muscular, por interacción con la actina.
La miosina es la proteína más abundante del músculo esquelético. Representa entre el 60% y 70% de las proteínas totales y es el mayor constituyente de los filamentos gruesos.
Contenido
Estructura y Composición
La miosina es una ATPasa, es decir, hidroliza el ATP para formar ADP y Pi, reacción que proporciona la contracción muscular.
La miosina está compuesta de 2 cadenas pesadas idénticas, cada una de 230 kDa,[1] y 4 cadenas livianas de 20 kDa cada una. La molécula tiene una región globular de doble cabeza unida a una larga cadena helicoidal de doble hebra. Cada cabeza se une a dos diferentes cadenas ligeras. Todas las miosinas tienen la secuencia:
Gly - Glu - Ser - Ala - Gly - Lys - Thr[cita requerida] que es similar a la secuencia encontrada en el sitio activo de otras ATPasas. La lisina se une al alfa fosfato del ATP.
La estructura α-helicoidal ininterrumpida de la cola de la miosina es favorecida por la ausencia de prolina en intervalos de más de 1000 residuos y por la abundancia de leucina, alanina y glutamato.
La porción globular de la miosina tiene actividad ATPásica y se combina con la actina. Dos de las cadenas ligeras son idénticas (una en cada cabeza) y pueden ser removidas sin pérdida de la actividad ATPásica. Las otras dos cadenas ligeras no son idénticas y se ven requeridas para la actividad ATPásica y para la unión de la miosina a la actina.
La miosina puede escindirse con la tripsina en dos fragmentos llamados meromiosina ligera y meromiosina pesada.
La meromiosina ligera forma filamentos, carece de actividad ATPásica y no se combina con la actina; es una cadena de doble hebra alfa helicoidal de 850 Å de longitud. La meromiosina pesada cataliza la hidrólisis del ATP, se une a la actina, pero no forma filamentos y genera la fuerza para la contracción muscular; consta de una barra corta unida a dos dominios globulares que son las cabezas de la miosina. La meromiosina pesada puede escindirse por la papaína en dos subfragmento en forma de bastón llamado S2. Cada fragmento S1 tiene un sitio con actividad ATPásica y un sitio de unión a la actina.
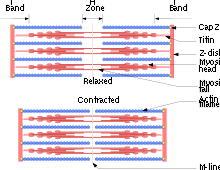
Cada miofibrilla consta de múltiples miofilamentos que son unas hebras delgadas o gruesas compuestas químicamente de dos proteínas especiales, actina y miosina. Los miofilamentos de una miofibrilla no abarcan toda la extensión de la fibra muscular sino que se dividen en compartimentos llamados sarcómeros.
La agrupación de miofilamentos delgados o de actina forman las bandas transversales claras de una miofibrilla y la agrupación de las segundas o de miosina, las bandas oscuras. Las primeras se conocen también como bandas I y las segundas como bandas A. Estas bandas se alternan. Las banda I y A en conjunto se denominan sarcómero. Además de la actina los miofilamentos delgados tienen otras dos moléculas de proteína que son troponiosiona y troponina que intervienen en la regulación de las contracciones musculares.
Un sarcómero está separado de los otros por zonas angostas de material denso que son las líneas Z. Los filamentos delgados se fijan en las líneas Z y se proyectan en ambas direcciones.
Además de actina, los miofilamentos delgados contienen otros dos tipos de proteína así como sitios receptores de miosina. Cada filamento de miosina posee unas pequeñas proyecciones denominadas puentes, las que al interactuar con los filamentos de actina producen la contracción.
Los miofilamentos gruesos se interdigitan con los extremos libres de los miofilamentos delgados y ocupan la banda A de la sarcómera. En la mitad de esta banda se aprecia la zona H. Las moléculas de miosina que la integran tienen zonas por las cuales pueden unirse a las moléculas de actina y otras, al AV caminando sobre un filamento de Actina F).[2] ]]
Miosina de tipo II
La miosina tipo II impulsa la contraccion muscular y la citocinesis. Se observan en este tipo de miosina las siguientes propiedades:
- La miosina de tipo 2 contiene dos cadenas pesadas, con una longitud aproximada de 2000 aminoácidos, y constituyen la cabeza y la cola del filamento de miosina. Cada una de estas cadenas pesadas contiene una N-terminal en la cabeza, presentando un engrosamiento en esta. Mientras que la cola es C-terminal y tiene una estructura helicoidal. Estas dos cadenas se unen formando una espiral, obteniendo así una miosina con dos cabezas.
- El tipo 2 de miosina contiene también cuatro cadenas ligeras (dos por cabeza) que ligan ambas cadenas pesadas por el "cuello", es decir, la región entre la cabeza y la cola. Estas cadenas ligeras están a menudo relacionadas con las cadenas ligeras esencial y reguladora.
Miosina de tipo V
Este tipo de miosina participa en el transporte intracelular de las vesiculas limitadas por receptores de membrana
Referencias
- ↑ Se lee: kilodalton
- ↑ Matthew L. Walker, Stan A. Burgess, James R. Sellers, Fei Wang, John A. Hammer III, John Trinick & Peter J. Knight. Two-headed Binding of a Processive Myosin to F-actin. Nature, 405, 804-807 (2000). http://www.fbs.leeds.ac.uk/research/contractility/myosinv/index.htm
- Pollard TD, Korn ED (Julio 1973). «Acanthamoeba myosin. I. Isolation from Acanthamoeba castellanii of an enzyme similar to muscle myosin». J. Biol. Chem. 248 (13): pp. 4682–90. PMID 4268863. http://www.jbc.org/cgi/pmidlookup?view=long&pmid=4268863.
- Lodish. Biologia Celular y Molecular.
Categoría:- Proteínas
Wikimedia foundation. 2010.