- Lisina
-
Lisina
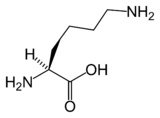
Nombre (IUPAC) sistemático Ácido 2,6-diaminohexanoico General Símbolo Lys, K Fórmula semidesarrollada Ver imagen Fórmula estructural Ver imagen Fórmula molecular C6H14N2O2 Identificadores Número CAS 70-54-2 (isómero L) PubChem Propiedades físicas Masa molar 146,19 g/mol Punto de fusión 497 K (223,85 °C) Propiedades químicas Acidez (pKa) 2,15; 9,16; 10,67 Solubilidad en agua 64,2 g/100 ml Bioquímica Familia Aminoácido Esencial Sí Codón AAA, AAG Punto isoeléctrico (pH) 9,74 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa lisina (abreviada Lys o K) es un aminoácido componente de las proteínas sintetizadas por los seres vivos. Es uno de los 10 aminoácidos esenciales para los seres humanos.
Contenido
Estructura química
Actúa químicamente como una base, al igual que la arginina y la histidina, ya que su cadena lateral contiene un grupo amino protonable que a menudo participa en puentes de hidrógeno y como base general en catálisis.
Este grupo amino, además de proveer de carga positiva a las proteínas, es acetilable por enzimas específicas, conocidas como acetiltransferasas. Se considera que esta acetilación es una modificación post-traduccional, puesto que se produce después de la traducción de la proteína a partir del ARN mensajero. Sin embargo, sus modificaciones post-traduccionales más comunes incluyen la metilación del grupo ε-amino, que da como resultado la metil-, dimetil- y la trimetillisina. Esto último ocurre en la calmodulina.
El colágeno contiene hidroxilisina, que se deriva de la lisina a través de la lisil hidroxilasa. La O-glicosilación de los residuos de lisina en el retículo endoplásmico o en el aparato de Golgi se utiliza para marcar ciertas proteínas para la secreción de la célula.
== Biosíntesis == Como aminoácido esencial, la lisina no se sintetiza en el organismo de los animales y, por consiguiente, éstos deben ingerirlo como lisina o como proteínas que contengan lisina. Existen dos rutas conocidas para la biosíntesis de este aminoácido. La primera se lleva a cabo en bacterias y plantas superiores, a través del ácido diaminopimélico, y la segunda en la mayor parte de hongos superiores, mediante el ácido α-aminoadípico. En las plantas y en los microorganismos la lisina se sintetiza a partir de ácido aspártico, que se convierte en primer lugar en β-aspartil-semialdehído. La ciclización genera dihidropicolinato, que se reduce a Δ1-piperidina-2,6-dicarboxylato. La apertura del anillo de este heterociclo genera una serie de derivados del ácido pimélico, que finalmente generará lisina. Algunas de las enzimas que participan en esta biosíntesis son las siguientes:Nelson, D. L.; Cox, M. M. Lehninger, Principles of Biochemistry, 3a. ed. Worth Publishing: New York, 2000. ISBN 1-57259-153-6.# Aspartokinasa # β-aspartato semialdehído deshidrogenasa # dihidropicolinato sintasa # Δ1-piperidina-2,6-dicarboxilato deshidrogenasa # N-succinil-2-amino-6ketopimelato sintasa # Succinil diaminopimelato aminotransferasa # Succinil diaminopimelato desuccinilasa # Diaminopimelato epimerasa # Diaminopimelato descarboxilasa
Metabolismo
La lisina se metaboliza en los mamíferos para dar acetil-CoA, a través de una transaminación inicial con α-cetoglutarato. La degradación bacteriana de la lisina da como resultado cadaverina, a través de un proceso de descarboxilación.
Síntesis
La lisina sintética, racémica, se conoce desde hace mucho tiempo.[1] Una síntesis práctica inicia a partir de caprolactama.[2]
Fuentes dietéticas
Los requerimientos nutricionales de lisina son de 1,5 g al día. En cantidades mínimas se encuentra en todos los cereales (gramíneas), pero es muy abundante en las legumbres. Contienen cantidades significativas de lisina:
- Alcaravea negra (16,200 - 20,700 ppm)
- Algarroba (26,320 ppm)
- Altramuz (19,330 - 21,585 ppm)
- Amaranto
- Berros (1340 - 26,800 ppm)
- Espárrago (21,360 - 23,304 ppm)
- Espinaca (1,740 - 20,664 ppm)
- Frijol (2390 - 25,700 ppm)
- Lenteja (7120 - 23,735 ppm) cultivada en vivero
- Lenteja (19,570 – 22,035 ppm)
- Nuez de la India (5370 - 25,165 ppm)
- Quinoa
- Soya (24,290 - 26,560 ppm)
- Kiwicha
Son buenas fuentes de lisina aquellos alimentos ricos en proteína: carnes (específicamente las carnes rojas, la de puerco y la de ave), queso (en particular el parmesano), algunos pescados (bacalao y sardinas) y huevos.
Propiedades
La L-lisina es un elemento necesario para la construcción de todas las proteínas del organismo. Desempeña un papel central en la absorción del calcio; en la construcción de las proteínas musculares; en la recuperación de las intervenciones quirúrgicas o de las lesiones deportivas, y en la producción de hormonas, enzimas y anticuerpos.
Importancia clínica
Se ha sugerido que la lisina puede ser benéfica para aquellas personas que presentan infecciones con herpes simple.[3] Sin embargo, hacen falta más estudios para corroborar esta afirmación. Véase Herpes simplex - Lysine.
Existen conjugados de lisina que resultan prometedoras para el tratamiento del cáncer, pues al parecer provocan que las células cancerosas se autodestruyan cuando el fármaco se utiliza en combinación con el uso de fototerapia, sin dañar a las células no cancerosas.[4]
La lisina, ingerida con L-carnitina, ayuda a que la carnitina disminuya notablemente los niveles de colesterol en la sangre.
Se dice también que la lisina ayuda al desarrollo mental, por lo que es bueno comenzar desde niño a consumir lisina. Por supuesto, a través de una prescripción médica.
La lisina estimula la liberación de la hormona del crecimiento. Esto ha hecho que se utilice, sola o combinada con otros aminoácidos, en niños para estimular el crecimiento y en ancianos para retrasar el envejecimiento.
Papel en la nutrición animal
La lisina es un aminoácido esencial limitante para muchas especies animales de importancia zootécnica. Como tal, cuando se equilibran formulaciones de alimentos para ganado se emplea el concepto de "aminoácido limitante" para incorporar la cantidad correcta en la dieta en base al contenido de lisina de los distintos alimentos proteicos disponibles y el posible empleo de lisina sintética. Esto último es común y muy económico de hacer en la alimentación de los cerdos y otras especies de interés zootécnico. El Objetivo es optimizar el crecimiento del ganado.
En el caso de la nutrición del ganado lechero la lisina es también limitante junto con la metionina, pero no se puede emplear lisina sintética directamente debido a que la fermentación microbiana en el rumen la destruye extensamente; sin embargo existen ya opciones de productos comerciales con una protección química que impide dicha degradación, aunque el empleo económico de dicha alternativa es aún disputable.
Curiosidades
En la novela de Michael Crichton Parque Jurásico y también en la adaptación cinematográfica de 1993 se presentan un dato falso o, por lo menos, información distorsionada: en ambas obras se dice que los dinosaurios del parque fueron alterados genéticamente (clonados) y que, por consiguiente, su organismo era incapaz de producir lisina. De esa manera los animales no abandonarían el parque: dependerían de los suplementos de lisina que les ofrecían los veterinarios.
La Lisina es el aminoácido favorito de Sheldon Cooper, uno de los protagonistas de la serie The Big Bang Theory de Warner Channel.
Bibliografía
- ↑ Braun, J. V. “Synthese des inaktiven Lysins aus Piperidin" Berichte der deutschen chemischen Gesellschaft 1909, Volume 42, p 839-846. DOI: 10.1002/cber.190904201134.
- ↑ Eck, J. C.; Marvel, C. S. “dl-Lysine Hydrochlorides” Organic Syntheses, Collected Volume 2, p.374 (1943). http://www.orgsyn.org/orgsyn/pdfs/CV2P0374.pdf
- ↑ Griffith RS, Norins AL, Kagan C. (1978). «A multicentered study of lysine therapy in Herpes simplex infection». Dermatologica. 156 (5): pp. 257-267. PMID 640102.
- ↑ ScienceDaily. «Chemists Kill Cancer Cells With Light-activated Molecules». Consultado el 24-01-2008.
Véase también
- Acetillisina
- Conspiración para fijar el precio de la lisina
- Desaminación
- Sacaropina
Fuentes
- La mayor parte de la información de este artículo se tradujo de la página de Wikipedia en inglés, que a su vez fue traducción de la página alemana (German Wikipedia).
Enlaces externos
- Sobre las primeras fases de la biosíntesis de la lisina (en inglés)
- [http://www.chem.qmul.ac.uk/iubmb/enzyme/reaction/AminoAcid/Lys2.html Sobre las últimas fases de la biosíntesis de la lisina (en inglés)
- [http://www.chem.qmul.ac.uk/iubmb/enzyme/reaction/AminoAcid/Lys3.html Sobre el catabolismo de la lisina (en inglés) (Queen Mary, University of London)
- Computational Chemistry Wiki en compchemwiki.org
- L-Lisina en PDRhealth.com
Categorías:- Aminoácidos
- Aminoácidos cetogénicos
- Aminoácidos básicos
- Aminoácidos esenciales
- Código ATC B
- Sustitutos del plasma
Wikimedia foundation. 2010.
