- Anhídrido acético
-
Anhídrido acético
Anhídrido acético 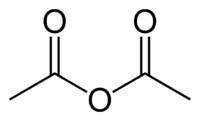
Nombre IUPAC Anhídrido acético,
anhídrido etanoicoOtros nombres Óxido de acetilo,
óxido acéticoFórmula empírica C4H6O3 Masa molecular 102,1 g/mol Estado físico/Color Líquido/Incoloro Número CAS 108-24-7 Propiedades Densidad 1,08 g/cm3 a 20 ºC Punto de fusión -73 °C (200 K) Punto de ebullición 139 °C (412 K) Solubilidad en agua Hidrólisis. Información de Seguridad 
Frases R: R10, R20/22, R34 Frases S: S26,S36/37/39,S45
Exenciones y Referencias[1] [2] El anhídrido acético, comúnmente abreviado Ac2O, es uno de los anhídridos carboxílicos más simples. Con fórmula química (CH3CO)2O, es uno de los reactivos más ampliamente usados en síntesis orgánica. Es un líquido incoloro, que huele fuertemente a vinagre (ácido acético) debido a su reacción con la humedad del aire.
Contenido
Propiedades
El anhídrido acético se disuelve en agua hasta aproximadamente un 2,6% (m/m).[3] Sin embargo, una solución acuosa de anhídrido acético no es estable porque éste descompone en unos pocos minutos (el tiempo exacto depende de la temperatura) en una solución de ácido acético.[4]
Producción
Industrialmente el anhídrido acético puede ser producido por oxidación del acetaldehído con O2, formándose ácido peracético CH3C(=O)OOH que reacciona catalíticamente con otra molécula de acetaldehído para dar el anhídrido acético; o por pirólisis del ácido acético a cetena CH2=C=O, la cual a continuación en una segunda etapa reacciona con una molécula de ácido acético para formar el anhídrido acético; o por carbonilación catalítica (empleando monóxido de carbono) del acetato de metilo.
Usos
En Ac2O es ampliamente empleado en química para la acetilación de alcoholes y aminas.
La mayor parte de la producción de anhídrido acético va a parar a la fabricación de acetato de celulosa (plásticos y fibras textiles).
Otras aplicaciones, por ejemplo, son la síntesis de la tetraacetiletilenodiamina (TAED) en la industria de detergentes, y la síntesis de fármacos tales como el ácido acetilsalicílico (aspirina) o el paracetamol.
También puede actuar como deshidratante.
Reacciones
La hidrólisis del anhídrido acético produce ácido acético:
- (CH3CO)2O + H2O → 2CH3COOH
El anhídrido acético es un agente acetilante que reacciona con nucleófilos, por ejemplo con alcoholes para formar ésteres acéticos:
- (CH3CO)2O + ROH → CH3COOR + CH3COOH
Seguridad
El anhídrido acético es corrosivo, irritante e inflamable.[5]
Referencias
- ↑ Celanese. «Ficha de Datos de Seguridad (FDS)». Consultado el 2009-01-20.
- ↑ British Petroleum. «Material Safety Data Sheet (MSDS)». Consultado el 2009-01-20.
- ↑ British Petroleum. «Acetic Anhydride: Frequently Asked Questions (PDF)». Consultado el 2009-01-20.
- ↑ Celanese. «Acetic Anhydride: Material Safety Data Sheet (PDF)». Consultado el 2009-01-20.
- ↑ «Ficha Internacional de Seguridad Química (FISQ)». Consultado el 2009-01-20.
Véase también
Categorías: Anhidridos ácidos | Materias primas
Wikimedia foundation. 2010.
