- Triatominae
-
Triatominae

Panstrongylus geniculatusEstado de conservación No amenazado Clasificación científica Reino: Animalia Filo: Arthropoda Clase: Insecta Orden: Hemiptera Familia: Reduviidae Subfamilia: Triatominae Los triatominos (Triatominae) son una subfamilia de insectos perteneciente a la familia Reduviidae del orden Hemiptera, conocidos a través de diversos nombres en diferentes regiones: vinchuca (desde Ecuador hasta la Patagonia), chipo (Venezuela), pito (Colombia) y barbeiro (Brasil), entre otros. Las aproximadamente 130 especies que conforman esta subfamilia son todas hematófagas, es decir, se alimentan de sangre de vertebrados. Excepcionalmente, algunas especies de triatominos se alimentan de otros invertebrados.[1] [2] La mayoría están distribuidas a lo largo de América, con algunas pocas especies presentes en Asia, África y Australia. Estos insectos generalmente conviven con vertebrados nidícolas de los cuales chupan sangre. Todas las especies de triatominos son vectores potenciales de la enfermedad de Chagas pero aquellas especies (como Triatoma infestans y Rhodnius prolixus) que se han adaptado a vivir con los seres humanos son consideradas "vectores importantes" del parásito responsable de esta enfermedad, Trypanosoma cruzi.
Contenido
El descubrimiento
A inicios del siglo XIX Charles Darwin hizo uno de los primeros reportes de la existencia de triatominos en América en su diario de notas comúnmente conocido como "El viaje del Beagle" (The Voyage of the Beagle). El siguiente es un extracto de lo que él escribió el 25 de marzo de 1835:
"Cruzamos el Luján, el cual es un río de talla considerable, si bien su curso hacia las costas del mar es poco conocido: es doblemente dudoso como, pasando sobre sendas planicies, no se evapora y se pierde. Dormimos en la ciudad Luján, la cual es un pequeño lugar rodeado por jardines, y constituye el distrito mas sureño en la Provincia de Mendoza; esta a cinco leguas al sur de la capital. Por la noche experimenté un ataque (no merece un nombre menor) de vinchucas, una especie de reduviideo, el gran chinche negro de las Pampas. Es de lo más molesto sentir estos insectos sin alas, de aproximadamente una pulgada de largo, trepando sobre el cuerpo. Antes de chupar se mantienen algo delgadas, pero luego se vuelven redondas e hinchadas de sangre, y en este estado se pueden aplastar fácilmente. Uno de los que llevé a Iquito, (también se consiguen en Chile y Perú) estaba muy vacío. Cuando se colocaba en una tabla, aun rodeado de gente, si se le presentaba un dedo, el insecto gallardo extendía inmediatamente su aparato chupador, atacaba, y si se le permitía, absorbía sangre. Ningún dolor causó la herida. Fue curioso ver su cuerpo durante el acto de succión, dado que en menos de 10 minutos este cambió de ser tan plano como una ostia hasta tomar una forma globular. Este banquete, el cual la vinchuca debió a uno de los oficiales, la mantuvo repleta durante cuatro meses enteros; pero la noche cuando se cumplían dos semanas, estaba ya casi lista para picar otra vez."Ha habido considerable especulación médica sobre la posibilidad de que el contacto que Darwin tuvo con los triatominos en Argentina haya estado relacionado con sus posteriores recaídas en una enfermedad de larga duración.
Descubrimiento de la relación de los triatominos con la enfermedad de Chagas
En 1909 el médico brasileño Carlos Chagas[3] descubrió que estos insectos eran responsables de la transmisión de T. cruzi a muchos de sus pacientes en Lassance, un poblado localizado sobre las orillas del Rio Sâo Francisco en Minas Gerais (Brasil). La gente pobre que vivía allí se quejaba de unos insectos que ellos llamaban "barbeiros" y que picaban durante la noche. Carlos Chagas colocó su primeras observaciones en palabras:
"Conociendo los hábitos domiciliarios del insecto, y su abundancia en todas los domicilios de la región, inmediatamente nos detuvimos, interesados en descubrir la biología exacta del barbeiro, y de la transmisión de algún parásito al hombre o a otro vertebrado."La relación entre el parásito, el vector y la sintomatología fue vista con escepticismo por la comunidad científica de aquel tiempo. Sin embargo, el argentino Salvador Mazza[4] retomó los estudios de Carlos Chagas, confirmó las observaciones de este en comunidades endémicas de Argentina y puso en pie una campaña de divulgación científica mundial sobre la enfermedad. El estudio de los triatominos tomó entonces relevancia por ser un problema de salud pública.
El brasileño, Herman Lent,[5] quien fue estudiante de Carlos Chagas, se consagró a la investigación de los triatominos y junto con Peter Wygodzinsky hizo una revisión de Triatominae que fue publicada en el Boletín del Museo Americano de Historia Natural (New York, 163 (3):125-520, figuras 1-320), un compendio de cuarenta años de estudios sobre los triatominos hasta 1979.
La idea propuesta por Chagas, Mazza y Lent de mejorar las condiciones de las viviendas como medida de control de los triatominos, sigue siendo hoy un principio fundamental en la lucha contra la enfermedad de Chagas. A este principio también se suma la necesidad de un cambio en el modelo de desarrollo económico implementado en las zonas rurales, el cual ocasiona un fuerte impacto en las mediaciones del domicilio humano, y de este modo presiona a diferentes especies de triatominos a abandonar su nicho natural.[6] [7]
Si bien, hoy día el papel que juegan los triatominos como vectores de la enfermedad de Chagas no se pone en duda entre la comunidad científica,[8] aun un alto porcentaje de las poblaciones afectadas por este mal ignora la relación de estos insectos con la enfermedad de Chagas. Esta situación evidencia la necesidad de un mayor desarrollo de los sistemas de educación pública latinoamericanos.
Ciclo biológico
Los triatominos desarrollan una metamorfosis incompleta, es decir, son hemimetábolos. Los huevos, generalmente blancos, varían en forma y tamaño según la especie; en R. prolixus miden 2 mm de largo y 0.8 mm de ancho y en T. infestans son entre 2 y 3 veces más grandes. Una hembra pone aproximadamente 10 huevos por semana y estos eclosionan luego de aproximadamente dos semanas. Una ninfa de primer estadio, que semeja un adulto, sale del huevo y pasa sucesivamente a través de los estadios 2, 3, 4 y 5. Finalmente, el quinto estadio pasa a adulto adquiriendo dos pares de alas. Los estadios ninfales duran varias semanas y hasta meses en función de su alimentación y especie. Los estadios 1, 2 y 3 pueden realizar la muda con una ingesta sanguínea completa, pero los estadios 4 y 5 normalmente requieren comer más de una vez para mudar. Los adultos pueden vivir varios meses e incluso más de un año.
El ciclo biológico es particularmente corto en R. prolixus pues puede completarse, desde el huevo al adulto, en menos de medio año en condiciones de humedad, temperatura, espacio y alimentación óptimas. Esta es una de las razones por la cual R. prolixus ha sido tan cotizado como modelo de diversos estudios fisiología y comportamiento. El mantenimiento de otras especies, tales como P. geniculatus y T. dimidiata, en el laboratorio, requiere de mayores cuidados.
Morfología y función
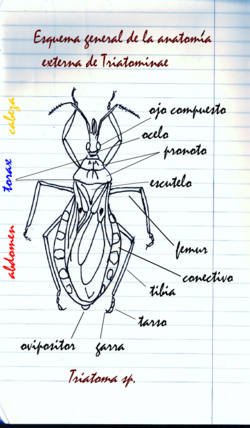
Antenas
Los triatominos poseen antenas de cuatro segmentos en ambos lados de la cabeza y frente a los ojos. El primer segmento basal o escapo está unido a la cabeza, luego le sigue un pedicelo y un flagelo compuesto en dos subsegmentos: flagelo distal y flagelo próximal. A estos dos últimos también se les llama flagelómeros y contienen la mayor parte de los pelos (u otras estructuras cuticulares) sensoriales que contienen sensores químicos, térmicos y táctiles.
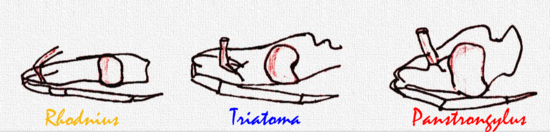
La distancia relativa entre las antenas y los ojos permite diagnosticar someramente los géneros Rhodnius, Triatoma y Panstrongylus; estos tres géneros comprenden las especies más importantes epidemiológicamente. En el último, Panstrongylus, las antenas están muy cerca de los ojos, en Rhodnius muy lejos (cerca del ápice de la cabeza) y en Triatoma a mitad de camino entre los ojos y el ápice de la cabeza. La distribución y abundancia de los pelos en las antenas es de utilidad en la clasificación de los triatominos.
Aparato bucal
El aparato bucal, también llamado proboscide o rostro, facilita la tarea de chupar sangre en los triatominos. Este apéndice chupador consiste en un labio segmentado en forma de canoa, cuyos bordes tienden a juntarse por encima, excepto en la base en donde se encuentra el labro, y que aloja a las demás piezas bucales que son finas y delgadas (estiletes) y constituyen dos maxilares y dos mandíbulas. El rostro de los triatominos posee tres segmentos y en el momento de picar se dobla especialmente a la altura de la articulación de los segmentos 2° y 3°, gracias a una porción membranosa allí existente. Las mandíbulas ayudan a perforar la epidermis y los maxilares penetran en busca de un vaso capilar. En rostro en posición de reposo termina casi siempre en el proesterno, en donde hay un espacio con pequeñas estrías transversales que constituye el surco estridulatorio.
El rostro es una característica común y ancestral entre los hemípteros. Una inspección rápida del rostro puede ayudar a distinguir un hemiptero triatomino de uno no hematófago. Este es largo en los hemípteros fitófagos y corto en los depredadores (entomófagos) y hematófagos, no alcanzando en este último caso el primer par de coxas. Además, en los depredadores el rostro es curvo, mientras que en los hematófagos triatominos es recto, de manera que en reposo descansa debajo de la cabeza en estrecha relación con ésta.
Tórax
Del tórax de los triatominos adultos vale la pena destacar que el pronoto, dividido en un lóbulo anterior y otro posterior, puede exhibir ornamentaciones tales como espinas y/o tubérculos de interés taxonómico. También es notorio que el mesonoto de los adultos está reducido a un escutelo.
Abdomen
El abdomen de los adultos está compuesto de 11 segmentos. Los segmentos del 2do al 8vo son notables en las hembras, aunque en el macho el 8vo es inaparente. El primer segmento está escondido en ambos sexos. Los últimos segmentos forman las genitalias de ambos sexos. El conectivo, es decir, la parte que bordea el abdomen, muestra un patrón de manchas que varia en color y formas según la especie.
Excepto la especie Triatoma espinolai, todas las formas adultas de triatominos son aladas. Las alas anteriores son hemélitros con una porción dura (corio) y otra membranosa (membrana). Esta características común en los hemípteros y a veces muy conspicua en algunos de sus miembros, le debe su nombre a este orden. Las alas posteriores que se doblan debajo de las primeras son delgadas y membranosas.
Las características de la genitalia permiten fácilmente diferenciar machos de hembras. En los machos la genitalia es redondeada y en las hembras es triangular y sobresale del abdomen.
Ninfas
Tal como lo expone Rodrigo Zeledón, las ninfas de los triatominos aunque parecen pequeños adultos, muestran características particulares:
"Las ninfas no sólo carecen de alas y de aparato genital, sino también de ocelos, escutelo y conectivo. En ellas el tórax posee sus tres porciones más o menos nítidas [pronoto, mesonoto y metanoto] y el abdomen muestra 10 segmentos, aunque los últimos son muy reducidos. Las características del tórax dorsal permiten reconocer cualquiera de los cinco estadios ninfales y el aspecto de los últimos segmentos abdominales de la ninfa de quinto estadio permite determinar el futuro sexo del adulto."Fisiología
Visión
Los triatominos tienen ojos compuestos con aproximadamente 300 omatidios cada uno. Son ojos de aposición con bastones o rabdomas abiertos (una característica común en Heteróptera), en los cuales un anillo de seis rabdómeros de las células retinulares 1-6, rodean a un par central de rabdómeros de las células retinulares 6 y 8. Si bien, los ojos de superposición generalmente son el sistema más adecuado para insectos de vida nocturna, los ojos de los triatominos cuentan con un sistema de adaptación a las condiciones de iluminación del día que les permite maximizar la cantidad de luz que llega a los receptores retinales en condiciones de poca luz.[9]
En condiciones de iluminación de baja intensidad (<0.06 microW/cm2), los triatominos muestran fotofobia a la luz natural y a luces monocromáticas con longitudes de onda de 397, 458, 499 y 555 nm. Son menos sensibles a las longitudes de onda de 357 nm (ultravioleta) y 621 nm (naranja oscuro), así como a longitudes de onda entre 665 y 695 nm (la parte roja del espectro).[10]
Los triatominos poseen también un par de ocelos (ojos simples)[11] sobre el dorso de la cabeza, detrás de los ojos compuestos. Estos muestran un completo desarrollo en el estado adulto. Los ocelos, junto con los ojos compuestos, regulan la respuesta fototáctica, es decir, los triatominos reconocen la iluminación del ambiente y responden a esta, generalmente evadiendo la luz intensa.[12]
Glándulas salivales
La estructura de las glándulas salivales ha sido estudiada en detalle en T. infestans.[13] Estas se puden observar fácilmente al arrancar la cabeza de un triatomino. Cada insecto presenta un par de estas glándulas y cada una contiene tres unidades que difieren en tamaño, color y función: unidad principal, unidad suplementaria y unidad accesoria. Cada unidad está constituida por una capa sencilla de células epiteliales que rodean un espacio central amplio. A su ves, las unidades glandulares están cubiertas por una lamina basal gruesa que contiene aglomeraciones de células musculares. Sobre la membrana celular sobresalen microvellosidades que incrementan la superficie de secreción hacia el espacio central. Ocasionalmente se observan vesículas sobresaliendo entre las microvellosidades. El interior de las células de las glándulas salivales contiene retículo endoplasmático en abundancia y algunos cuerpos lípidos.
La saliva de los triatominos tiene como función principal evitar que su picadura produzca señales de alerta en el huésped y facilitar el transito de sangre hacia el intestino. Está equipada con sustancias que contrarrestan los procesos de defensa de los sistemas circulatorio e inmune de la víctima de la picada. Contiene proteínas especializadas (lipocalinas y similares) para inhibir la cascada de la coagulación, limitar la activación de las plaquetas y prevenir la vasoconstricción. Otras sutancias adicionales sirven para apaciguar la respuesta de dolor, inflamatoria e inmune del huésped.
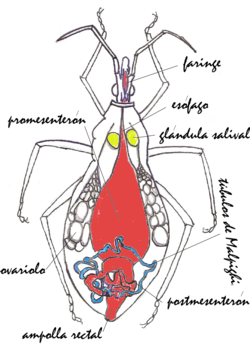
Aparato digestivo
Los triatominos succionan sangre a través de la probóscide. La sangre ingerida pasa a la faringe, luego al esófago y se almacena en el estómago o promesenterón. En el esófago y promesenterón se encuentran más del 95% de los simbiontes. Eventualmente, la ingesta pasa al postmesenterón que consiste en una especie de "intestino delgado". En la parte anterior del postmesenterón la sangre sufre un proceso de digestión, y en la parte posterior, un proceso de absorción. Finalmente, los restos de la ingesta, así como algunas bacterias simbiontes y parásitos tripanosómidos, son evacuados a través del recto.
Cuando un triatomino está infectado con el protozoario que produce la enfermedad de Chagas, T. cruzi, los epimastigotes de este se ubican a lo largo de todo el intestino delgado, hasta el recto. Sin embargo, los tripomastigotes metacíclicos, las formas de T. cruzi que pueden infectar al huésped vertebrado, solo se desarrollan en el recto. La composición bioquímica del tracto de los triatominos determina estos estados de desarrollo.
La mayor parte de grupos de insectos utilizan las serino proteasas (tripsinas y quimotripsinas) y esterasas como las enzimas digestivas principales, en acorde con el pH neutro o básico de sus tractos digestivos. Sin embargo, el interior del tracto digestivo de algunos insectos, incluyendo los hemípteros, es ácido y utiliza un tipo diferente de enzimas, las cisteo y/o asparto proteasas. En el caso particular de los triatominos, se han identificado varios tipos de enzimas digestivas: proteasas ácidas (catepsinas B, D y L), carboxipeptidasa de lisosoma B y aminopeptidasa.
Simbiontes
Dado que los triatominos son estrictamente hematófagos, estos no consiguen en la sangre ciertos componentes esenciales de su dieta, de modo que necesitan la ayuda de bacterias que actúan como simbiontes que producen sustancias tales como la vitamina B. A diferencia de muchos artrópodos hematófagos, los simbiontes de los triatominos no están insertos en células o tejidos especializados, sino que viven libres en su tracto digestivo, específicamente, en el cardia y estómago. Además, estos organismos son transmitidos de generación en generación cuando los triatominos se alimentan de las deyecciones fecales (coprofagia) o la sangre presente en el abdomen de sus congéneres (canibalismo). El hecho de que estos insectos se agreguen en colonias facilita el desarrollo de ese comportamiento.
La primera bacteria identificada en un triatomino fue Rhodococcus rhodnii en R. prolixus.[14] Eventualmente otras species de actinomicetes, principalmente de los géneros Rhodococcus y Nocardia, ambos de la familia Nocardiaceae, han sido reportadas en el intestino de los triatominos. También se han conseguido otros géneros tales como Gordonia, Streptococcus, Staphylococcus, Corynebacterum, Mycobacterium, Pseudomonas y Echericha.[15]
La ausencia de simbiontes (aposimbiosis) en el intestino de los triatominos causa varios efectos deletreos que incluyen: a) retardo en el desarrollo juvenil, b) incremento en la mortalidad juvenil, c) problemas para digerir la sangre y para defecar y d) reducción del sistema traqueal. Infecciones con los protozoarios tripanozomatidos Blastocrithidia triatominae (común en Triatoma) y Trypanosoma rangeli (común en Rhodnius) producen efectos similares. Este fenómeno no se observa con T. cruzi. Es probable que los tripanozomátidos B. triatominae y T. rangeli diezmen las poblaciones de las bacterias simbiontes y en consecuencia sus beneficios.[16]El uso de simbiontes modificados genéticamente como aplicación para el control de estos vectores está siendo evaluado por varios grupos de investigación.[17] Las bacterias modificadas genéticamente expresarían agentes capaces de inactivar los tripanosomas en el intestino del triatomino. El desarrollo de este proyecto implica el riesgo de causar daños ecológicos, dados los efectos que estos transgénicos podrían causar al ser liberados en regiones endémicas de Latinoamérica.
Homeostasis y excreción
Los triatominos toman sangre que equivale aproximadamente a 10 veces su peso en los 3 primeros estadios ninfales, y entre 3 y 4 veces su peso en los estadios ninfales 4 y 5 y en la fase adulta.[18] Este excesiva ingesta de líquido implica un eventual desequilibrio fisiológico y vulnerabilidad frente a sus depredadores. La digestión de las proteínas y purinas contenidas en la sangre conlleva a la producción de altas cantidades de amoníaco, el cual por ser sumamente tóxico debe ser transformado rápidamente y eventualmente excretado.
El órgano esencial del sistema de homeostasis y excretor de los triatominos lo constituyen los tubos de Malpighi. Estos consisten en cuatro túbulos ciegos, delgados (30-100 μm) y relativamente largos (2-100 mm) embebidos en la hemolinfa del insecto que se conectan al recto a través de ampollas. Las cuatro ampollas forman una especie de roseta alrededor en la conexión del tubo digestivo delgado con el recto. La pared de los túbulos está formada por una capa de células. Cada tubo está compuesto en dos segmentos que varían en estructura y función. El segmento distal o posterior es traslúcido y un tanto amarillento, y toma sustancias tóxicas, sales y agua de la hemolínfa. El otro segmento, proximal o anterior (conectado al recto) es generalmente de color blanco opaco y está implicado en la reabsorción de sales hacia la hemolinfa. Existen diferencias entre los tipos celulares de cada segmento.
Los triatominos convierten el amoníaco en ácido úrico, una estrategia común en artrópodos terrestres. El ácido úrico es relativamente insoluble e inerte, por lo cual puede ser retenido en forma de cristales por largos períodos de tiempo y expulsado con bajo consumo de agua. La síntesis de ácido úrico ocurre principalmente en los cuerpos grasos e implica la adición progresiva de amoníaco. Puesto que la molécula de ácido úrico tiene un solo átomo de hidrógeno por cada átomo de nitrógeno, los triatominos utilizan menos agua para su síntesis. Esta estrategia resulta conveniente dado que los triatominos pueden pasar semanas y hasta meses sin suministro (sanguíneo) de agua. El ácido úrico pasa a los túbulos de Malpighi a través de una ruta aun desconocida y de allí al recto de donde es excretado en forma de discos blanco amarillentos.
Glándulas exocrinas
Los triatominos tienen cinco diferentes pares de glándulas que al igual que en otros reduvideos se encuentran en el tórax o en el abdomen: glándulas metasternales, glándulas de Brindley, glándulas dérmicas (similares a las glandulas de Brindley pero más pequeñas), glándulas ventrales y glándulas abdominales. Las más estudiadas son las dos primeras, las cuales producen olores y sabores de beneficio para el insecto.
Glándulas de Brindley: Estas son estructuras simples con forma saco y se extienden dorsalmente en la parte lateral del segundo segmento abdominal, aunque son de origen metatoráxico y se abren en el episterno metatoráxico justo arriba del lóbulo supracoxal del episterno III. En las especies donde estas glándulas han sido descritas no se ha encontrado diferencia de talla entre hembras y machos. Segregan ácido isobutírico y otros ácidos carboxílicos, así como, alcoholes y esteres.
Glándulas metasternales: Están ubicadas en la parte ventral del metatorax, tienen forma de pera y poseen un tubo sin ramificaiones cada una. Cada tubo se retuerce entre el metendosternito y la cavidad metacoxal. Estas glándulas no poseen pigmentos ni glándulas accesorias. Su apertura es diminuta y puede observarse claramente en la parte lateral de la cavidad apofisea esternal. Las glándulas metasternales han sido descritas en al menos 12 especies de Triatominae. Son más pequeñas en la tribu Rhodniini que en la tribu Triatomini. La secreción de estas glándulas ha sido reportada en Panstrongylus geniculatus como una sustancia muy volátil y sin color, en cambio en T. infestans su color es amarillento. En las glandulas metastermales de Dipetalogaster maxima se ha identificado 3-metil-2-hexanona. Las glándulas metastermales de las hembras de R. prolixus, T. infestans y T. brasiliensis producen una feromona que atrea a los machos.
Véase también: Fisiología y Ecología Sensorial en TriatominaeEpidemiología
Tanto las especies domésticas (que habitan en el domicilio o peridomicilio humano) como las especies selváticas, pueden transmitir el parásito de la enfermedad de Chagas a los seres humanos y a los mamíferos; las aves son inmunes al parásito. La enfermedad es transmitida principalmente de persona a persona a través de los triatominos: el parásito T. cruzi es llevado del vertebrado al insecto a través de la sangre, y del insecto al vertebrado a través de las heces del primero, y no a través de la saliva.[19]
Los triatominos viven principalmente en domicilios de gente pobre, hechos con materiales rústicos y donde hay poca higiene. Se puede reconocer la presencia de triatominos en una casa por sus deyecciones fecales, restos de muda, huevos o reconociendo los mismos insectos. Estos generalmente dejan dos tipos de heces como líneas sobre las paredes de casas infectadas; unas son blancas con ácido úrico, otras son oscuras (negras) conteniendo residuos de sangre. Los huevos blanquecinos o los restos de muda pueden ser conseguidos en las ranuras de las paredes o en el suelo. Luego de chupar sangre estos individuos se mueven con dificultad y se les puede identificar fácilmente.
La colonización del hábitat humano por especies tales como P. geniculatus, que normalmente fueron consideradas "sélvaticas", evidencia la capacidad de adaptación de estas especies a ambientes poco habituales.[20] La búsqueda del nicho doméstico por parte de las especies selváticas es consecuencia de la perturbación de su nicho selvático (deforestación, caza incontrolada de huéspedes naturales, etc) que ha llevado a menoscabar sus fuentes de alimentación. Estas especies se han visto forzadas a recurrir a fuentes alimentarias en el domicilio humano, donde generalmente habitan familias de escasos recursos. Estos domicilios presentan condiciones que facilitan la colonización de los triatominos tales como, la cercanía de animales domésticos a las habitaciones y la infraestructura de la viviendas, que presentan grietas en las paredes y techos de palma que proveen refugio a los triatominos.
Comportamiento
Hábitos
Los triatominos se agregan en refugios durante el día y salen en búsqueda de sangre bajo el cobijo de la noche, cuando el huésped duerme y el aire es fresco. Tanto los cinco estadios ninfales como los adultos son hematófagos. La mayor parte de las especies están asociadas con vertebrados nidícolas y son llamadas triatominos silvestres. Estos viven en madrigueras bajo la tierra con roedores o armadillos, o sobre los árboles con murciélagos, perezosas o rabipelados. Algunas pocas especies (5%) viven en habitaciones humanas o en sus alrededores (peridomicilio) con los animales domésticos, a estas se les conoce como especies domésticas. Muchas especies selváticas de triatominos están en proceso de domiciliación ("semidomésticas").
Orientación
Los triatominos se mueven por varias razones: para buscar comida, para conseguir pareja, en búsqueda de refugio o un lugar para alojarse, para escapar de depredadores o simplemente para explorar nuevos territorios. Tanto las ninfas como los adultos caminan (a 20±15 mm/s)[21] para alcanzar cualquiera de estos objetivos, aunque ocasionalmente y bajo ciertas circunstancias algunos adultos vuelan distancias relativamente cortas. Con suerte un triatomino puede conseguir una ingesta sanguínea, refugio o un sitio para alojarse aun cuando sea transportado pasivamente o si llega a alguno de estos destino por azar. Por ejemplo, R. prolixus puede alcanzar el hábitat doméstico siendo transportado en las hojas de palma que se utilizan en la construcción de casas rurales y P. geniculatus puede entrar en las casas volando hipnotizado por la luz proveniente de una casa en medio de la noche tropical. Sin embargo, la posibilidades de encontrar algún recurso necesario serán mayores si el insecto utiliza información ambiental que lo lleve de manera eficiente a su objetivo.
Agregación
Los triatominos, de hábitos nocturnos, se agregan especialmente al final de la noche; generalmente regresan a su refugio luego de chupar sangre y guiados por olores que ellos mismos han depositado allí. En el refugio consiguen sexo, protección y condiciones de humedad y temperatura más favorables que en el exterior, de modo que allí permanecen durante el día; la mayor parte del tiempo en un estado de inmovilidad. Se ha observado que si bien el comportamiento de agregación es cíclico, este no parece estar regulado de manera endógena por un reloj circadiano.[22]
Comunicación
La conocida capacidad de los triatominos para agregarse denota la presencia de mecanismos de comunicación que implican el uso de quimo y mecano recepción. En la búsqueda de olores que medien la comunicación en estos insectos se han detectado olores producidos por varias glándulas. Los triatominos adultos producen un olor molesto (ácido isobutírico) cuando son molestados, el cual aparentemente también sirve de señal de alarma; se ha especulado mucho sobre la función de del ácido isobutírico como feromona de agregación o sexual, pero no se han encontrado evidencias experimentales. Por otro lado, al parecer algunos de los olores producidos por la glandula metastermal de estos insectos estén implicados en su comportamiento sexual.[23] [24] [25]
Cuando los triatominos están excitados también son capaces de emitir un sonido, apenas perceptible para el oído humano, frotando el sulco estridulatorio bajo la cabeza con movimientos rápidos del rostro. Tal vez este sonido también tenga alguna función de reconocimiento sexual.[26]
Véase también: Fisiología y Ecología Sensorial en TriatominaeEstímulos relevantes
Tanto los olores como el calor que emanan del huésped sirven de guía para localizar al huésped. La olfacción en los triatominos ha sido objeto de varias investigaciones. El dióxido de carbono de la respiración, así como el amonio, aminas y ácidos grasos de cadena corta que emanan de la piel, pelos y glándulas exocrinas de los animales vertebrados, están entre las moléculas que componen los olores que atraen a los triatominos. La visión también sirve en la orientación de estos insectos. Durante la noche los adultos de varias especies vuelan a domicilios humanos atraídos por la luz. Luego que alcanza la piel del huésped y antes de picarlo, los triatominos utilizan los termoreceptores de sus antenas para localizar los vasos sanguíneos, una tarea que requiere precisión, dado que estos vasos ocupan menos del 5% de la piel.[27]
Véase también: Fisiología y Ecología Sensorial en TriatominaeTribus, géneros y número de especies descritas
- Alberproseniini
- Alberprosenia 2 (A. goyovargasi, A. malheiroi)
- Bolboderini
- Belminus 8 (B. corredori, B. costaricencis, B. ferroae, B. herreri, B. laportei, B. peruvianus, B. pittieri, B. rugulosus)
- Bolbodera 1 (B. scabrosa)
- Microtriatoma 2 (M. borbai, M. trinidadensis)
- Parabelminus 2 (P. carioca, P. yurupucu)
- Cavernicolini
- Cavernícola 2 (C. lenti, C. pilosa)
- Torrealbaia 1 (T. martinezi)
- Linshcosteusinii
- Linshcosteus 6 (L. carnifex, L. chota, L. confumus, L. costalis, L. kali, L. karupus)
- Rhodniini
- Psammolestes 3 (P. arthuri, P. coreodes, P. tertius)
- Rhodnius 16 (R. amazonicus, R. brethesi, R. colombiensis, R. dalessandroi, R. domesticus, R. ecuadoriensis, R. milesi, R. nasatus, R. neglectus, R. neivai, R. pallescens, R. paraensis, R. pictipes, R. prolixus, R. robustus, R. stali)
- Triatomini
- Dipetalogaster 1 (D. maxima)
- Eratyrus 2 (E. cuspidatus, E. mucronatus)
- Hermanlentia 1 (H. matsunoi)
- Meccus 6 (M. bassolsae, M. longipennis, M. mazzottii, M. pallidipennis, M. phyllosomus, M. picturatus)
- Mepraia 2 (M. gajardoi, M. spinolai)
- Nesotriatoma 3 (N. bruneri, N. flavida, N. obscura)
- Panstrongylus 13 (P. chinai, P. diasi, P. geniculatus, P. guentheri, P. howardi, P. humeralis, P. lenti, P. lignarius, P. lutzi, P. megistus, P. rufotuberculatus, P. sherlocki, P. tupynambai)
- Paratriatoma 1 (P. hirsuta)
- Triatoma 67 (T. amicitiae, T. arthurneivai, T. baratai, T. barberi, T. bolivari, T. bouvieri, T. brailovskyi, T. brasiliensis, T. breyeri, T. carcavalloi, T. carrioni, T. cavernícola, T. circummaculata, T. costalimai, T. deaneorum, T. delpontei, T. dimidiata, T. dispar, T. eratyrusiformis, T. garciabesi, T. gerstaeckeri, T. gomeznunezi, T. guasayana, T. guazu, T. hegneri, T. incrassate, T. indictiva, T. infestans infestans, T. infestans melanosoma, T. juazeirensis, T. jurbergi, T. klugi, T. lecticularia, T. lenti, T. leopoldi, T. limai, T. maculata, T. matogrossensis, T. melanica, T. melanocephala, T. mexicana, T. migrans, T. neotomae, T. nigromaculata, T. nitida, T. oliveirai, T. patagonica, T. peninsularis, T. petrochiae, T. platensis, T. protracta, T. pseudomaculata, T. pugasi, T. recurva, T. rubida, T. rubrofasciata, T. rubrovaria, T. ryckmani, T. sanguisuga, T. sherlocki, T. sinaloensis, T. sinica, T. sordida, T. tibiamaculata, T. vandae, T. venosa, T. vitticeps, T. williami, T. wygodzinskyi)
Nota: Para más detalles ver Galvão et al (2004)
Los vectores más importantes
Todas las 139 especies de Triatominae son potencialmente capaces de transmitir el parásito T. cruzi a los seres humanos pero las siguientes cinco especies constituyen los vectores de la enfermedad de Chagas más importantes epidemiológicamente.
- Triatoma infestans
- Rhodnius prolixus
- Triatoma dimidiata
- Triatoma brasiliensis
- Panstrongylus megistus
Bibliografía
- Brenner RR, Stoka AM (1987) Chagas’ disease vectors. I, II and III. CRC Press. Boca Ratón
- Dujardin JP, Shcofield CJ, Panzera F (2000) Les vecteurs de la maladie de Chagas: recherches taxonomiques, biologiques et génétiques. Academie Royale des Sciences d'Ultre-Mer. Belguium.
- Dunston PA (1999) Assassin Bugs. Science Publishers Inc., Enfield, New Hampshire. 337 pp.
- ECLAT = European Community - Latin American Network for Research on the Biology and Control of Triatominae http://eclat.fcien.edu.uy/
- Galvão C, Carcavallo R, da Silva Rorcha D, Jurberg J (2004) A checklist of the current valid species of the subfamily Triatominae Jeannel, 1919 (Hemiptera, Reduviidae) and their geographical distribution, with nomenclatural and taxonomic notes. Zootaxa 202: 1-36
- Lent H, Wygodzinsky P (1979) Revision of the Triatominae (Hemiptera, Reduviidae), and their significance as vectors of Chagas disease. Bull Am Mus Nat Hist 163:123–520
- Maldonado-Capriles, Jenaro (1990) Systematic Catalogue of the Reduviidae of the World. Special Edition of the Caribbean Journal of Science. University of Puerto Rico, Mayaguez, Puerto Rico. 694 pp.
- Otálora-Luna F (2006) Chemosensory and behavioural adaptations for haematophagy in triatomine bugs (Heteroptera: Reduviidae). Université de Neuchâtel. Disponible en la Web (Video suplementario en Curiosidades)
- Rozendaal JA (1997) Vector control: Methods for use by individuals and communities. WHO Disponible en la Web
- Schofield CJ (1994) Triatominae: biology & control. Eurocommunica Publications. West Sussex. UK 80 pp.
- Schofield CJ (2000) Biosystematics and evolution of the Triatominae. Cad. Saúde Pública. [online]. vol.16 suppl.2 [cited 06 May 2005], p.89-92. ISSN 0102-311X. Disponible en la Web
- Zeledón R (1981) El Triatoma dimidiata (Latreille, 1811) y su relación con la enfermedad de Chagas. Editorial Universidad Estatal a Distancia. Costa Rica
- Zeledón R, Rabinovich (1981) Chagas' disease: an ecological appraisal with special emphasis on its insect vectors. Annu Rev Entomol 26:101-33 Disponible en la Web
Notas
- ↑ Sandoval CM, Duarte R, Gutiérrez R, Rocha DS, Angulo VM, Esteban L, Reyes M, Jurberg J, Galvão C (2004) Feeding sources and natural infection of Belminus herreri (Hemiptera, Reduviidae, Triatominae) from dwellings in Cesar, Colombia. Mem Inst Oswaldo Cruz 99(2):137-140 Disponible en la Web
- ↑ Sandoval CM, Joya M, Gutiérrez M, Angulo VM (2000) Cleptohaematophagy of the Triatominae bug Belminus herreri. Med Vet Entomol 14(1):100-101
- ↑ Lewinsohnn R (1981) Carlos Chagas and the discovery of Chagas' disease (american trypanosomiasis). J Royal Society of Medicine 74:451-455 Disponible en la Web
- ↑ Moratal Ibañez LM, Carli AJ, Kennel B (2006) Mal de Chagas. La enfermedad de la pobreza, Casas de fuego (1995). R Med Cine 2:66-73 Disponible en la Web
- ↑ Rodrigues Coura J (2001) In Honor to Herman Lent’s 90 Years and to his Major Contribuitions to the Memórias do Instituto Oswaldo Cruz. Mem Inst Oswaldo Cruz 96:1029-1032 Disponible en la Web
- ↑ Coimbra Jr. CEA (1988) Human Settlements, Demographic Pattern, and Epidemiology in Lowland Amazonia: The Case of Chagas's Disease. Am Anthropol 90:82-97
- ↑ Briceño-León, R (2007) Chagas disease and globalization of the Amazon Cad. Saúde Pública 23(suppl.1):S33-S40
- ↑ Morel CM (1999) Chagas disease, from discovery to control -and beyond: history, myths and lessons to take home. Mem Inst Oswaldo Cruz 94:Suppl I:3-16 Disponible en la Web
- ↑ Reisenman CE, Insausti TC, Lazzari CR (2002) Light-induced and circadian changes in the compound eye of the haematophagous bug Triatoma infestans (Hemiptera: Reduviidae) J Exp Bio 205:201–210 Disponible en la Web
- ↑ Reisenman CE, Lazzari CR (2006) Spectral sensitivity of the photonegative reaction of the blood-sucking bug Triatoma infestans (Heteroptera: Reduviidae). J Comp Physiol A 192:39-44
- ↑ Insausti TC, Lazzari CR (2002) The fine structure of the ocelli of Triatoma infestans (Hemiptera: Reduviidae). Tissue Cell 34:437-49
- ↑ Lazzari CR, Reiseman CE, Insausti TC (1998) The role of the ocelli in the phototactic behaviour of the haematophagous bug Triatoma infestans. J Insect Physiol 44:1159-1162
- ↑ Reis MM, Meirelles RM, Soares MJ (2003) Fine structure of the salivary glands of Triatoma infestans (Hemiptera:Reduviidae). Tissue Cell. 35:393-400
- ↑ Erikson D (1935) The pathogenic aerobic organisms of the Actinomyces group. Medical Research Council Special Report Series 203:5–61
- ↑ Duglas AE, Beard CB (1996) Microbial symbioses in the midgut of insects. In: Lehane MJ, Billingsley PF (eds) Biology of the insect midgut. Chapman & Hall, Cambridge
- ↑ Eichler S, Schaub GA (2001) Development of symbionts in triatomine bugs and the effects of infections with trypanosomatids. Experimental Parasitology 100: 17–27
- ↑ Dotson EM, Plikaytis B, Shinnick TM, Durvasula RV, Beard CB (2003) Transformation of Rhodococcus rhodnii, a symbiont of the Chagas disease vector Rhodnius prolixus, with integrative elements of the L1 mycobacteriophage. 3:103-9
- ↑ Martini, Sabrina V, Nascimento, Suzete B. and Morales, Marcelo M (2007) Rhodnius prolixus Malpighian tubules and control of diuresis by neurohormones. An Acad Bras Ciênc 79:87-95 Disponible en la Web
- ↑ Este es el caso del hemoflagelado T. rangeli, transmitido al ser humano y otros vertebrados a través de la picada de los triatominos. Si bien T. rangeli no causa patología alguna en los seres humanos, dificulta el diagnostico de T. cruzi pues puede producir falsos positivos.
- ↑ Rodríguez-Bonfante et al (2007) Epidemiology of Chagas disease in Andrés Eloy Blanco, Lara, Venezuela: triatomine infestation and human seroprevalence. Cad Saúde Pública 23:1133-1140 Disponible en la Web
- ↑ Otálora-Luna F, Perret JL, Guerin PM (2004) Appetence behaviours of the triatomine bug Rhodnius prolixus on a servosphere in response to the host metabolites carbon dioxide and ammonia. J Comp Physiol A 190:847-54 Disponible en la Web
- ↑ Minoli SA, Baraballe S, Lorenzo Figueiras AN (2007) Daily rhythm of aggregation in the haematophagous bug Triatoma infestans (Heteroptera: Reduviidae). Mem Inst Oswaldo Cruz 102(4):449-454 Disponible en la Web
- ↑ Manrique G, Vitta AC, Ferreira RA, Zani CL, Unelius CR, Lazzari CR, Diotaiuti L, Lorenzo MG (2006) Chemical communication in chagas disease vectors. source, identity, and potential function of volatiles released by the metasternal and Brindley's glands of Triatoma infestans adults. J Chem Ecol 32:2035-52 Disponible en la Web
- ↑ Crespo JG, Manrique G (2007) Mating behavior of the hematophagous bug Triatoma infestans: role of Brindley's and metasternal glands. J Insect Physiol 53:708-14 [1]
- ↑ Pontes GB, Bohman B, Unelius CR, Lorenzo MG (2008) Metasternal gland volatiles and sexual communication in the triatomine bug, Rhodnius prolixus J Chem Ecol 34:450-7
- ↑ Reyes-Lugo M.I, Díaz-Bello Z, Abate T, Avilán A (2006) Stridulatory sound emission of Panstrongylus rufotuberculatus Champion, 1899, (Hemiptera: Reduviidae: Triatominae). Brazilian Journal of Biology 66:443-446 Disponible en la Web
- ↑ Ferreira RA, Lazzari CR, Lorenzo MG, Pereira MH (2007) Do Haematophagous bugs assess skin surface temperature to detect blood vessels? PloS ONE 2:e932 Disponible en la Web
Véase también
Enlaces externos
- Laboratorio de Fisiología de Insectos, Universidad de Buenos Aires, Argentina
- Laboratório de Triatomíneos e Epidemiología da Doença de Chagas, Centro de Pesquisas René Rachou-Fiocruz, Brazil
- Laboratorio de Entomología "Herman Lent", Universidad de Los Andes, Venezuela
- Laboratório Nacional e Internacional de Referência em Taxonomía de Triatomíneos, FIOCRUZ, Brasil
- ECLAT = European Community Latin American Network for Research on the Biology and Control of Triatominae
Videos
- Alberproseniini
Wikimedia foundation. 2010.