- Integrina
-
Integrina alfa, región citoplásmica Identificadores Símbolo Integrina alfa Pfam PF00357 InterPro IPR000413 PROSITE PDOC00215 SCOP 1dpk Estructuras en PDB: PDB 1dpk, PDB 1dpq, PDB 1kup, PDB 1kuz, PDB 1m8o, PDB 1s4w Integrina alfa Identificadores Símbolo Integrina alfa 2 InterPro IPR013649 SCOP 1jv2 Estructuras en PDB: PDB 1jv2, PDB 1l5g, PDB 1m1x, PDB 1u8c Integrina, cadena beta Identificadores Símbolo Integrina beta Pfam PF00362 InterPro PR012012 PROSITE PDOC00216 SCOP 1jv2 Estructuras en PDB: PDB 1jv2, PDB 1kup, PDB 1kuz, PDB 1l3y, PDB 1l5g, PDB 1m1x, PDB 1m8o, PDB 1s4x, PDB 1txv, PDB 1ty3, PDB 1ty5, PDB 1ty6, PDB 1ty7, PDB 1tye, PDB 1u8c Las integrinas son una superfamilia de glicoproteínas que participan mayormente en la unión de las células con la matriz extracelular, aunque hay algunas que también participan en la unión célula-célula. Están presentes en la superficie celular en elevadas concentraciones.
Contenido
Estructura
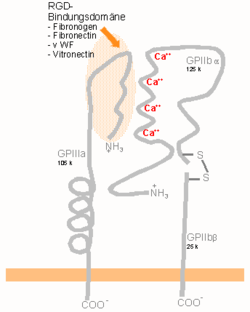
Las integrinas son heterodímeros obligados que contienen dos tipos de cadenas distintas, la subuindad α (alfa) y la subunidad β (beta), que se unen de forma no covalente. Las cadenas α contienen aproximadamente entre 1.000 y 1.200 residuos, en cambio las cadenas β tienen entre 760 y 790 residuos. En los mamíferos, se han caracterizado 18 subunidades alfa y 8 subunidades beta, mientras que el genoma de Drosophila codifica únicamente cinco subunidades alfa y dos beta, y el nematodo Caenorhabditis dos alfa y dos beta.[1] Ambas subunidades poseen dos extremos separados, que penetran en la membrana plasmática y tienen pequeños dominios citoplásmicos.[2] A continuación se indican los genes de integrinas caracterizados hasta la fecha:
Cadenas alfa
Gen Proteína Sinónimos ITGA1 CD49a VLA1 ITGA2 CD49b VLA2 ITGA3 CD49c VLA3 ITGA4 CD49d VLA4 ITGA5 CD49e VLA5 ITGA6 CD49f VLA6 ITGA7 ITGA7 FLJ25220 ITGA8 ITGA8 ITGA9 ITGA9 RLC ITGA10 ITGA10 ITGA11 ITGA11 HsT18964 ITGAD CD11D FLJ39841 ITGAE CD103 HUMINAE ITGAL CD11a LFA1A ITGAM CD11b MAC-1 ITGAV CD51 VNRA, MSK8 ITGAW ITGAW ITGAX CD11c Además, variantes de algunas de las subunidades son formadas por splicing alternativo, como por ejemplo, las 4 variantes de la subunidad beta 1. Por medio de diferentes combinaciones de estas subunidades alfa y beta, se generan 24 integrinas únicas, aunque el número varía según el estudio que se tenga en cuenta.[3]
Las subunidades de las integrinas quedan incluidas en la membrana plasmática y, en general, tienen dominios citoplásmicos muy cortos, de unos 40-70 aminoácidos. La excepción es la subunidad beta 4, que posee un dominio citoplásmico de 1.088 aminoácidos, siendo así uno de los dominios citoplásmicos más largos conocidos de cualquier proteína de membrana. Fuera de la membrana plasmática de la célula, las cadenas alfa y beta se sitúan bastante cerca entre sí, a una distancia de unos 23 nm. El extremo N-terminal de cada cadena forma una región de unión a ligando.
La masa molecular de las integrinas puede variar de 90 a 160 kDa. Las subunidades β tienen secuencias repetidas ricas en cisteínas. Tanto la subunidad α como la β pueden unir diversos cationes divalentes. El papel de la subunidad α es desconocido, pero podría estar implicada en la estabilización del plegamiento de las proteínas. La subunidad β es más interesante, ya que está directamente involucrada en la coordinación de al menos algunos ligandos que se unen a la integrina.
Existen varias formas de categorizar las integrinas. Por ejemplo, un subconjunto de cadenas α poseen un elemento estructural adicional (o "dominio") insertado en su extremo N-terminal, el llamado dominio alfa-A (debido a su similitud estructural con los dominios A encontrados en el factor de von Willebrand, también denominado dominio α-I). Las integrinas poseen este dominio bien unido al colágeno (como es el caso de las integrinas α1 β1 y α2 β1), o bien actuando como moléculas de adhesión célula-célula (como es el caso de las integrinas de la familia β2. Este dominio α-I es el sitio de unión de los ligandos que se unen a las integrinas. Aquellas integrinas que no llevan este dominio insertado, también tienen un dominio A en su sitio de unión a ligando, pero este dominio A se localiza en la subunidad β.
En ambos casos, los dominios A incluyen sitios de unión de tres cationes divalentes. Uno de ellos está permanentemente ocupado a concentraciones fisiológicas de los cationes divalentes, y une o calcio o magnesio, los principales cationes divalentes de la sangre que se encuentran a una concentración media de 1,4 mM (calcio) y 0,8 mM (magnesio). Los otros dos sitios pueden ser ocupados por cationes cuando el ligando se encuentra unido a la integrina (al menos, aquellos ligandos que poseen un aminoácido ácido en sus sitios de interacción).
Estructura de alta resolución
A pesar de muchos años de esfuerzo, el descubrimiento de la estructura de las integrina a alta resolución sigue siendo un reto: las proteínas de membrana son proteínas de difícil purificación, y las integrinas son además grandes, complejas y están unidas a multitud de azúcares (están altamente "glicosiladas"). Se han combinado imágenes de baja resolución de la integrina GPIIbIIIa en extractos de detergente, obtenidas mediante microscopía electrónica, y datos obtenidos mediante técnicas indirectas, estudiando las propiedades de las integrinas en solución mediante ultracentrifugación y light scattering, con datos fragmentarios de cristalografía de alta resolución o de RMN de dominios únicos o emparejados de algunas cadenas de integrinas, y con modelos moleculares para predecir el resto de la estructura de las cadenas. A pesar de todo ello, la estructura obtenida mediante cristalografía de rayos X para la región extracelular completa de la integrina αvβ3 resultó inesperada y sorprendente.[4]
Se demostró como la molécula se encuentra plegada en forma de "V" invertida, con los sitios de unión a ligando cerca de la membrana celular. La estructura cristalográfica también fue obtenida en el caso de esta misma integrina unida a un pequeño ligando que poseía la secuencia RGD (arginina-glicina-aspártico), el fármaco cilengitida.[5] Estos datos revelaron finalmente por qué los cationes divalentes de los dominios A son críticos para la unión de la secuencia RGD del ligando a la integrina. La interacción con tales secuencias parece ser una primera fase mediante la cual la matriz extracelular ejerce su efecto en el comportamiento celular.
La estructura suscita numerosas cuestiones, especialmente en lo referente a la unión del ligando y la transducción de la señal. El sitio de unión al ligando está dirigido hacia el extremo C-terminal de la integrina, la región donde la molécula emerge de la membrana celular. Si emerge ortogonalmente de la membrana, el sitio de unión a ligando sería aparentemente obstruido, especialmente teniendo en cuenta que los ligandos de las integrinas suelen encontrarse a elevadas concentraciones, y entrecruzado con los componente de la matriz extracelular. De hecho, poco se conoce acerca del ángulo existente entre las proteínas de membrana y el plano de la misma; este es un problema difícil de abordar con las tecnologías actuales. Por defecto, se asume que las proteínas emergen en forma de pequeñas "piruletas", algo de lo que no existe ninguna evidencia.
Aunque la estructura cristalina de la integrina antes mencionada sorprendentemente apenas cambia cuando lleva unida la cilengitida, la actual hipótesis es que la función de la integrina implica cambios en la forma para mover el sitio de unión a ligando a una posición más accesible en la superficie celular, y este cambio conformacional pone en funcionamiento la señalización intracelular. Hay una gran cantidad de literatura biológica y bioquímica que apoya esta hipótesis. Quizás, la evidencia más convincente es la que ofrece el uso de anticuerpos que sólo reconocen integrinas cuando están unidas a sus correspondientes ligandos, o cuando están activadas. Pues to que la "huella" que deja el anticuerpo en su diana de unión es más o menos un círculo de 3 nm de diámetro, la resolución de esta técnica es baja. En cualquier caso, estos denominados anticuerpos LIBS (Ligand-Induced-Binding-Sites), demuestran inequívocamente que la forma de la integrina sufre un cambio drástico al unirse a su ligando.
Función
Fundamentalmente son receptores de membrana, algunos reconocen fibronectina, laminina, que son componentes mayoritarios de la matriz extracelular. Algunas de estas integrinas pueden ser específicas para una sola molécula, pero en cambio hay otras que pueden reconocer diferentes ligandos.
Las integrinas β1 forman dímeros con, como mínimo, 9 tipos distintos de cadenas alfa.
Las β2, dimerizan con al menos tres tipos de cadenas alfa y median contactos célula-célula. Hay algunas que están muy estudiadas, como son LFA1 o el antígeno de función linfocitaria αLβ2. Mayormente se encuentra en la superficie de los leucocitos. αmβ2 es el equivalente al anterior pero se presenta en los macrófagos. VLA-4 esta en los linfocitos. Los receptores para estas tres moléculas son I-CAM y V-CAM, que se encuentran en la superficie de las células endoteliales.
Las β3, se pueden hallar en plaquetas, entre otro tipo de células, y se unen a proteínas como el fibrinógeno, participando en la coagulación sanguínea.
En el interior celular principalmente se ligan a moléculas de actina, excepto las integrinas que poseen la cadena β4 que pueden unirse a los filamentos intermedios, como la queratina. Participan en uniones hemidesmosomales, habiéndose caracterizado principalmente dos; una de ellas tiene siempre la cadena α6 mientras que la otra contiene siempre β4. Las integrinas también desempeñan un papel fundamental en la adhesión de los leucocitos al endotelio, cuando estos migran hacia un foco inflamado. Intervienen en la “parada” de los leucocitos y permite el paso de éstos a través del endotelio.
Anclaje de la célula a la matriz extracelular
Las integrinas asocian a la matriz extracelular con el citoesqueleto de la célula. El tipo de ligando que se unirá a una u otra integrina vendrá dado por el tipo de subunidades α y β que posea la integrina. Entre los múltiple ligandos de las integrinas se encuentran la fibronectina, la vitronectina, el colágeno y la laminina. La conexión entre la célula y la matriz extracelular podría ayudar a que la célula soporte fuerzas de empuje sin ser arrancada de la matriz. La capacidad de la célula para crear este tipo de unión es de vital importancia en la ontogenia.
El anclaje de la célula a la matriz extracelular es un requerimiento básico para la formación de un organismo pluricelular. Las integrinas no son simples garfios, sino que transmiten numerosas señales críticas sobre el entorno que rodea a la célula. Junto con la señales recibidas por los receptores celulares para factores de crecimiento solubles como VEGF o EGF, refuerzan la capacidad de la célula a la hora de tomar decisiones biológicas: moverse, ser anclada, morir, diferenciarse, etc. Por ello, las integrinas se encuentran en el centro de multitud de procesos biológicos. El anclaje de la célula se produce a través de la formación de complejos de adhesión celular, que se componen de integrinas y otras muchas proteínas citoplásmicas tales como talina, vinculina, paxilina y alfa-actinina. Dicho anclaje es regulado por quinasas tales como FAK (quinasa de adhesión focal) y los miembros de la la familia Src quinasa, que fosforilan ciertos sustratos como p130CAS, dando lugar al reclutamiento de adaptadores de señalización del tipo CRK. Estos complejos de adhesión se anclan al citoesqueleto de actina. De este modo, las integrinas sirven para unir a lo largo de la membrana dos redes: la matriz extracelular y el sistema de filamentos de actina intracelular.
Una de las funciones más importantes de las integrinas de superficie es su papel en la migración celular. Las células se adhieren a los sustratos por medio de sus integrinas. Durante ese movimiento, la célula forma nuevos anclajes con el sustrato en la dirección del movimiento, a la vez que libera otros ya formados en la parte posterior. Cuando se liberan del sustrato, las moléculas de integrina retornan al interior de la célula mediante procesos de endocitosis, siendo enviados en vesículas a la región anterior donde serán devueltos a la superficie. Es decir, son reciclados constantemente, permitiendo que la célula tenga anclajes de refresco en su región frontal.
Transducción de señales
Las integrinas juegan un papel crucial en la señalización celular. La conexión con los componentes de la matriz extracelular pueden causar una señal que será transmitida al interior celular por medio de una quinasa que se encuentra indirecta y temporalmente conectada con el extremo intracelular de la integrina, probablemente recibiendo los cambios conformacionales inducidos por la unión con componentes de la matriz extracelular. Las señales que recibe la célula a través de las integrinas pueden dar lugar a diversos procesos celulares como los que se indican a continuación:
- Crecimiento celular.
- División celular.
- Supervivencia celular.
- Diferenciación celular.
- Apoptosis.
Integrinas de vertebrados
A continuación se muestran algunas de las integrinas encontradas en vertebrados:
Nombre Sinónimos Distribución Ligandos α1β1 Múltiple Colágenos, lamininas.[6] α2β1 Múltiple Colágenos, lamininas[6] Células hematopoyéticas Fibronectina, VCAM-1[6] proteinasas α6β1 Receptor de laminina Múltiple Lamininas y componentes de matriz extracelular Linfocitos T ICAM-1, ICAM-2[6] Neutrófilos y monocitos Proteínas plasmáticas, ICAM-1[6] αIIbβ3 Plaquetas[6] Fibrinógeno, fibronectina[6] melanoma, glioblastoma Vitronectina,[7] fibronectina, fibrinógeno, osteopontina, Cyr61 fibroblastos, células epiteliales Vitronectina y adenovirus αVβ6 Epitelios proliferativos, esp. pulmón e hígado Fibronectina; TGFβ1+3 α6β4 Células epiteliales[6] Laminina[6] La cadena beta 1 de las integrinas interacciona con múltiples tipos de cadenas alfa. Estudios llevados a cabo en ratones knockout para diversos genes de integrinas no siempre son letales, lo que demuestra que durante la embriogénesis algunas integrinas pueden ser sustituidas por otras, permitiendo así la supervivencia del mutante.
Algunas integrinas se situan en la superficie celular en un estado inactivo, pudiendo ser rápidamente activadas por citoquinas a un estado capaz de unir sus ligandos. Las integrinas pueden adoptar diversas formas o estados conformacionales bien definidos. Una vez activadas, el estado conformacional cambia para estimular la unión de ligandos de modo que se activen los receptores, que también varían su conformación para dar comienzo a la transducción de señales.
Referencias
- ↑ Humphries M.J. (2000). «Integrin structure». Biochem. Soc. Trans. 28 (4): pp. 311–339. doi:. PMID 10961914.
- ↑ Nermut MV, Green NM, Eason P, Yamada SS, Yamada KM (December 1988). «Electron microscopy and structural model of human fibronectin receptor». Embo J. 7 (13): pp. 4093–9. PMID 2977331.
- ↑ Hynes R (2002). «Integrins: bidirectional, allosteric signaling machines». Cell 110 (6): pp. 673–87. doi:. PMID 12297042.
- ↑ Xiong JP (2001). «Crystal structure of the extracellular segment of integrin αvβ3». Science 294 (5541): pp. 339–345. doi:. PMID 11546839.
- ↑ Smith J (2003). «Cilengitide Merck». Curr Opin Investig Drugs 4 (6): pp. 741–5. PMID 12901235.
- ↑ a b c d e f g h i j k l m Molecular cell biology. Lodish, Harvey F. 5. ed. : – New York : W. H. Freeman and Co., 2003, 973 s. b ill. ISBN 0-7167-4366-3
- ↑ a b Hermann P, Armant M, Brown E, Rubio M, Ishihara H, Ulrich D, Caspary RG, Lindberg FP, Armitage R, Maliszewski C, Delespesse G, Sarfati M (February 1999). «The vitronectin receptor and its associated CD47 molecule mediates proinflammatory cytokine synthesis in human monocytes by interaction with soluble CD23». J. Cell Biol. 144 (4): pp. 767–75. doi:. PMID 10037797. PMC 2132927. http://www.jcb.org/cgi/pmidlookup?view=long&pmid=10037797.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Integrinas. Commons
Wikimedia Commons alberga contenido multimedia sobre Integrinas. Commons- La proteína Integrina
- Animación del mapa de la proteolisis
- MeSH Integrins
Categorías:- Compuestos orgánicos
- Glicoproteínas
- Receptores celulares
Wikimedia foundation. 2010.