- Ácido isociánico
-
Ácido isociánico
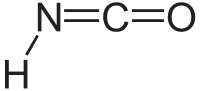
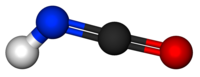
Nombre (IUPAC) sistemático Ácido isociánico General Otros nombres Isocianato de hidrógeno Fórmula semidesarrollada HNCO Fórmula molecular HNCO Identificadores Número CAS 75-13-8 Propiedades físicas Apariencia Líquido incoloro o gas (cerca de temperatura ambiente) Densidad 1140 kg/m3; 1,14 g/cm3 Masa molar 43.03 g/mol Punto de fusión 187.15 K (–86 °C) Punto de ebullición 296.65 K (23.5 °C) Propiedades químicas Solubilidad en agua Soluble en agua, benceno, tolueno y éter Compuestos relacionados Isocianato
Cianato
Ácido ciánicoValores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasÉl ácido isociánico es un compuesto inorgánico con la fórmula HNCO, descubierto en 1830 por Liebig y Wöhler.[1] Esta sustancia incolora es volátil y venenosa, con un punto de fusión de 23.5 °C. El ácido isociánico es el compuesto químico más sencillo formado por hidrógeno, nitrógeno carbono y oxígeno, y es uno de los cuatro elementos más encontrados en la química orgánica y la biología.
Contenido
Preparación y reacciones
El ácido isociánico puede ser sintetizado al añadir protones al anión isocianato, en sales como cianato de potasio con el cloruro de hidrógeno o el ácido oxálico.,[2] por ejemplo:
- H+ + NCO- → HNCO
El ácido isociánico también puede ser sintetizado en la descomposición a altas temperaturas del ácido cianúrico, un trímero.
El ácido isociánico hidroliza a dióxido de carbono y amoníaco:
- HNCO + H2O → CO2 + NH3
En concentraciones altas, el ácido isociánico oligomeriza para dar ácido cianúrico y ciamelida, un polímero. Estas especies químicas son normalmente fáciles de separar de los productos de la reacción. Las disoluciones diluidas del ácido isociánico son estables en disolventes inertes, por ejemplo éter.[3]
El ácido isociánico reacciona con grupos amino para dar ureas:
- HNCO + RNH2 → RNHC(O)NH2
Isómeros
La fotólisis de sólidos a baja temperatura de HNCO suele dar lugar a H-O-C≡N, conocido como ácido ciánico o cianato de hidrógeno; es un tautómero.[4] del ácido isociánico. El ácido ciánico en estado puro no ha sido aislado y el ácido isociánico es la forma predomninante en todos los disolventes.[3] Nótese que a veces cuando se cita el ácido ciánico se está refiriendo al ácido isociánico.
Los ácidos ciánico e isociánico son isómeros del ácido fulmínico (H-C=N-O), un compuesto inestable.[5]
Véase también
Referencias
- ↑ Liebig, J.; Wöhler, F. (1830). «Untersuchungen über die Cyansäuren». Ann. Phys. 20: pp. 394. doi:. http://gallica.bnf.fr/ark:/12148/bpt6k15105c/f377.table.
- ↑ Fischer, G.; Geith, J.; Klapötke, T. M.; Krumm B. (2002). «Synthesis, Properties and Dimerization Study of Isocyanic Acid». Z. Naturforschung 57b (1): pp. 19–25. http://www.znaturforsch.com/ab/v57b/s57b0019.pdf.
- ↑ a b A. S. Narula, K. Ramachandran “Isocyanic Acid” in Encyclopedia of Reagents for Organic Synthesis, 2001, John Wiley & Sons, New York. doi 10.1002/047084289X.ri072m Article Online Posting Date: April 15, 2001.
- ↑ Jacox, M.E.; Milligan, D.E. (1964). «Low-Temperature Infrared Study of Intermediates in the Photolysis of HNCO and DNCO». Journal of Chemical Physics 40: pp. 2457–2460. doi:.
- ↑ Kurzer, Frederick (2000). «Fulminic Acid in the History of Organic Chemistry». Journal of Chemical Education 77: pp. 851–857.
Más información
- Handbook of Chemistry and Physics, 65th. Edition, CRC Press (1984)
Enlaces externos
- Walter, Wolfgang (1997). Organic Chemistry: A Comprehensive Degree Text and Source Book. Chichester: Albion Publishing. p. 364. http://books.google.com/books?id=RXX2RaCplmAC&pg=PA364&lpg=PA364&dq=isocyanic+acid+melting+point&source=web&ots=4cqYfxJape&sig=D4gJVjg49MSwkNSP7eqC5PB7nWs&hl=en&sa=X&oi=book_result&resnum=3&ct=result.
- Cyanic acid from NIST Chemistry WebBook (accessed 2006-09-09)
Categorías:- Ácidos orgánicos
- Oxácidos con carbono
- Oxácidos con nitrógeno
- Compuestos inorgánicos de carbono
Wikimedia foundation. 2010.
