- Ácido oxálico
-
Ácido oxálico
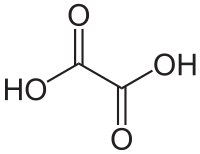
Nombre (IUPAC) sistemático ácido etanodioico General Fórmula semidesarrollada HOOC-COOH Fórmula molecular C2H2O4 Identificadores Número CAS 144-62-7 Propiedades físicas Estado de agregación sólido Apariencia cristales blancos Densidad 1900 kg/m3; 1,9 g/cm3 Masa molar 90,03 g/mol Punto de fusión 374,65 K (101,5 °C) Punto de ebullición 638,15 K (365 °C) Punto de descomposición 462,65 K ( °C) Propiedades químicas Acidez (pKa) 1,19 Solubilidad en agua 9.5 g/100 mL (15 °C) Peligrosidad Punto de inflamabilidad 462,15 K (189,15 °C) NFPA 704 Riesgos Inhalación Puede producir irritación severa y quemaduras en nariz, garganta y tracto respiratorio. Piel Riesgo de irritación severa y posibles quemaduras. Puede ser absorbido a través de la piel. Ojos Irritante ocular. Puede producir efectos corrosivos. LD50 375 mg/kg (en ratas, vía oral) Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl ácido oxálico es un ácido carboxílico de fórmula H2C2O4. Este ácido bicarboxílico es mejor descrito mediante la fórmula HOOCCOOH. Su nombre deriva del género de plantas Oxalis, por su presencia natural en ellas, hecho descubierto por Wiegleb en 1776. Posteriormente se encontró también en una amplia gama de otros vegetales, incluyendo algunos consumidos como alimento como el ruibarbo o las espinacas.
Es un ácido orgánico relativamente fuerte, siendo unas 3.000 veces mas potente que el ácido acético. El bi-anión, denominado oxalato, es tanto un agente reductor como un elemento de conexión en la química. Numerosos iones metálicos forman precipitados insolubles con el oxalato, un ejemplo destacado en este sentido es el del oxalato de calcio, el cual es el principal constituyente de la forma más común de cálculos renales.
Contenido
Propiedades
Es el diácido orgánico más simple. Soluble en alcohol y agua, cristaliza facilmente en el agua en forma dihidratada. Su punto de fusión hidratado es de 101,5 °C. Es un ácido fuerte en su primera etapa de disociación debido a la proximidad del segundo grupo carboxílico.
Calentándolo se descompone liberando principalmente dióxido de carbono (CO2), monóxido de carbono (CO) y agua.
Pruebas analíticas clásicas
Formación de un precipitado blanco en disolución neutra con sales de calcio que se redisuelve en ácido. Reacciona con permanganato (MnO4-) reduciéndolo a manganeso(II) y oxidándose a carbonato o CO2:
5 H2C2O4 + 2 MnO4- + 6 H+ -> 10 CO2 + 2 Mn2+ + 8 H2O
Nomenclatura
Los sales y ésteres de este ácido se denominan oxalatos. El oxalato actúa como ligando quelante, uniéndose a un átomo central a través de dos átomos de oxígeno.
Síntesis
El ácido oxálico se obtiene hoy en día por calentamiento de formiato sódico (NaO2CH) a 360 °C bajo liberación de hidrógeno, precipitación del ácido en forma de oxalato cálcico con leche de cal y finalmente liberación del ácido con ácido sulfúrico.
Aplicaciones y usos
- En apicultura este ácido es utilizado en el control de varroasis enfermedad causada por ácaros del género Varroa que atacan a las abejas melíferas. Por su acción toxicológica, es objetada su utilización por algunos autores en la apicultura, si bien la miel contiene de forma natural este ácido, por lo cual se considera el tratamiento con ácido oxálico como orgánico. Hay mieles que naturalmente tienen alta concentración de ácido oxálico como es el caso de la miel de almendro (Prunus dulcis), dependiendo la concentración del mismo en miel de la flora nectífera que la abeja pecorea.
- En la Construcción y Aseo del Hogar, para pulir pisos de mármol y similares y limpiar baños, sanitarios y lavamanos.
- En la Curtiembre para blanqueo y protección de cueros curtidos contra la putrefacción por procesos realizados con Taninos y Cromo.
- En el Lavado de Ropa, para remover hierro y otros metales que manchan la ropa y para neutralizar el exceso de alcalinidad de los detergentes. En la Industria Textil, también como auxiliar en baños de teñido y en pastas de estampación. Se usa también como catalizador en las resinas aplicadas a las telas de “planchado permanente”
- En la Industria Metalmecánica, como componente en baños de limpieza, decapado y fosfatizado de metales, para remover los óxidos y depositar películas que proveen protección y lubricación. (En anodización del aluminio, forma películas puras, resistentes a la corrosión y a la abrasión, de colores atractivos)
Referencias externas
- The Chemical Database Ficha técnica y de seguridad (en inglés)
- Mallinckrodt BakerFicha de seguridad del ácido oxálico (en inglés)
Categorías:- Ácidos dicarboxílicos
- Oxalatos
Wikimedia foundation. 2010.

