- 2,3-dimetilbutano
-
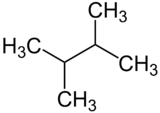
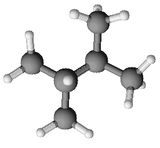
2,3-dimetilbutano
Nombre (IUPAC) sistemático 2,3-Dimetilbutano General Otros nombres Diisopropilo Fórmula estructural (CH3)2CHCH(CH3)2 Fórmula molecular C6H14 Identificadores Número CAS 79-29-8 Propiedades físicas Estado de agregación líquido Apariencia incoloro, transparente, inodoro. Densidad 662 kg/m3; 0,662 g/cm3 Masa molar 86,1754 g/mol Punto de fusión 244 K (-29,15 °C) Punto de ebullición 331 K (57,85 °C) Propiedades químicas Compuestos relacionados Alcanos ramificados 2,2-dimetilbutano Peligrosidad Punto de inflamabilidad 244 K (-29 °C) NFPA 704 Frases R R11 R38 R65 R51 R53 Frases S S2 S9 S16 S29 S33 S61 S62 Riesgos F: Fácilmente inflamable.
N: Peligro para el medio ambiente.
Xn:Nocivo.Ingestión Puede causar irritación del tracto digestivo. La aspiración de material hacia los pulmones puede causar neumonía química, que puede
resultar fatal.[1]Inhalación Puede causar irritación del tracto respiratorio.
La inhalación de vapores puede causar adormecimiento y mareo.Piel Puede causar enrojecimiento, sequedad e inflamación. Ojos Puede causar irritación ocular. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl 2,3-dimetillbutano es un hidrocarburo de cadena ramificada, de la familia de los alcanos. Su fórmula empírica es C6H14 y su fórmula semidesarrollada es (CH3)2CHCH(CH3)2.
Es uno de los isómeros del hexano. Se emplea como combustible por tener un índice de octano alto.[2]
Contenido
Obtención
A partir de derivados halogenados
- Se puede obtener mediante una síntesis de Wurtz, a partir de 2-bromopropano, en presencia de sodio:[3]

o partiendo de otro 2-halopropano:
- A partir de un derivado 2-halogenado de propano con litio en presencia de éter etílico y haluro de litio:
![\scriptstyle (CH_3)_2CHX + 2 \, Li \xrightarrow[-LiX]{|Et_2O|} (CH_3)_2CHLi](7/28758ce8a32226573c30135ff33da834.png)
que posteriormente:- A partir de derivados monohalogenados (como el 1-cloro-2,3-dimetilbutano o el 2-cloro-2,3-dimetilbutano):
1. Tratados con hidrácidos en presencia de zinc:

ó bien

2. Con tetrahidruro de aluminio y litio, LiAlH4, o con tetrahidruro de boro y sodio, NaBH4:

o bien

3. Con hidrácidos como yoduro de hidrógeno:

o bien

4. Con litio, en presencia de éter etílico, se forman compuestos de organolitio, y posterior hidrólisis para obtener el 2,3-dimetilbutano.

-
-
-
 y posterior hidrólisis
y posterior hidrólisis
-
-

o bien

-
-
-
 y posterior hidrólisis
y posterior hidrólisis
-
-

5. Con magnesio, en presencia de éter etílico, se forman compuestos de organomagnesio, y posterior hidrólisis para obtener el 2,3-dimetilbutano.
-
-
-
 y posterior hidrólisis
y posterior hidrólisis
-
-

o bien

-
-
-
 y posterior hidrólisis
y posterior hidrólisis
-
-

Por hidrogenación de alquenos.
1. A partir de 2,3-dimetil-2-buteno, usando níquel como catalizador::

2. A partir de 2,3-dimetil-1,3-butadieno, usando níquel como catalizador:

A partir de aldehídos
Por tratamiento del aldehído 2,3-dimetilbutanal con hidrazina, (reacción de Wolf-Kishner):

A partir de sales sódicas de ácido carboxílico
1. Por hidrólisis de 3,4-dimetilpentanoato sódico, (CH3)2CΗCΗ(CH3)CH2COONa, en caliente:

- El NaHCO3 formado se descompone en NaOH y CO2 por lo que la reacción resultante es:

2. Por hidrólisis de 2,2,3-trimetilbutanoato sódico, (CH3)2CHC(CH3)2COONa en caliente:

- Igualmente, el NaHCO3 formado se descompone en NaOH y CO2, por lo que globalmente resulta:

Síntesis industrial
1. Obtención de haluro de etilo por reacción de hidrácido (ΗΧ) con etileno, C2H4:

2. Tratamiento con cianuro sódico y obtención de propanonitrilo:

3. Obtención de ácido propanoico por hidrólisis:

4. Reducción del ácido propanoico por LiAlH4 y obtención de propan-1-ol:

5. Deshidratación con ácido sulfúrico en caliente y obtención de propeno:
![\scriptstyle CH_3CH_2CH_2OH \xrightarrow[170^oC]{\pi .H_2SO_4} CH_3CH=CH_2 + H_2O](4/9645c935785a6c131e357d914c896e21.png)
6. Tratamientocon hidrácido y obtención de monoderivado halogenado, preferentemente en el carbono secundario (2-haluro de alquilo):

7. Tratamiento con sodio (síntesis de Wurtz):

Propiedades
Es un líquido incoloro e inodoro, fácilmente inflamable. Puede resultar nocivo para las personas y el medio ambiente.
Reactividad
- No debe exponerse a altas temperaturas por el riesgo de incendio, ya que arde con facilidad:

- No debe exponerse a oxidantes fuertes.
- Sufre reacciones de halogenación radicalaria, como por ejemplo, en presencia del radical cloro, Cl·. En este caso se forma una mezcla al 50% de 1-cloro-2,3-dimetillbutano y de 2-cloro-2,3-dimetillbutano. Esto indica que el radical cloro posee una mayor afinidad por los hidrógenos secundarios (átomos de H unidos a carbono secundario) que por los hidrógenos primarios, ya que esta molécula posee 12 hidrógenos primarios y sólo dos hidrógenos secundarios, y la sustitución resulta ser al 50%.[4]

Referencias
- ↑ Hoja de datos de seguridad. Fisher Scientific.
- ↑ 2,3-dimetilbutano en Answers.com
- ↑ Química: Teoría y problemas. José Antonio García Pérez. Editorial Tébar, 1996. ISBN: 8473601556. Pág. 340
- ↑ Química orgánica. Stephen J Weininger, Frank R. Stermitz. Editorial Reverté, 1988. ISBN: 842917527X. Pág.161
Véase también
- hexano
- isómero
- alcano
- hidrocarburo
- 2-metilpentano
- 3-metilpentano
- 2,2-dimetilbutano
Wikimedia foundation. 2010.







