- Hidruro de litio
-
Hidruro de litio
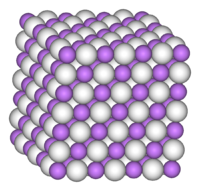
Nombre (IUPAC) sistemático Hidruro de litio General Fórmula semidesarrollada LiH Fórmula molecular LiH Identificadores Número CAS 7580-67-8 Número RTECS OJ6300000 Propiedades físicas Estado de agregación sólido Apariencia incoloro a gris Densidad 820 kg/m3; 0,82 g/cm3 Masa molar 7,95 g/mol g/mol Punto de fusión 965 K (691,85 °C) Estructura cristalina Estructura cúbica centrada en las caras (CCC) (tipo NaCl) Propiedades químicas Solubilidad en agua Reacciona con agua Compuestos relacionados Otros cationes hidruro de sodio
hidruro de potasio
hidruro de rubidio
hidruro de cesioOtros aniones borohidruro de litio
hidruro de aluminio y litioTermoquímica ΔfH0sólido -11.39 kJ/g kJ/mol Peligrosidad Punto de inflamabilidad 473 K (200 °C) NFPA 704 Número RTECS OJ6300000 Riesgos Más información ICSC 0813[1] [2] Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl hidruro de litio (LiH) es un compuesto químico de litio e hidrógeno. Es un sólido cristalino incoloro, aunque las muestras comerciales presentan aspecto grisáceo. Esta sal inorgánica está formada por cationes litio Li+ y aniones hidruro H-, y, como es característico de los hidruros salinos, o iónicos, tiene un alto punto de fusión, de 689 °C. Por la extraordinaria ligereza de sus iones, que resulta en una masa molecular de aproximadamente 8, su densidad es de 780 kilogramos por metro cúbico (kg/m3), la más baja de los compuestos salinos. Tiene una capacidad calorífica estándar de 29,73 J/mol.K con una conductividad térmica que varía con la composición y la presión (desde al menos 10 hasta 5 W/mK a 400 K) y disminuye con la temperatura.
El anión hidruro en general es muy reactivo frente al aire, al agua y a agentes oxidantes; un catión duro y poco electrón-atrayente como el litio no puede darle la relativa estabilidad que se encuentra, por ejemplo, en el hidruro de zinc. Así, el hidruro de litio es un sólido inflamable y muy reactivo con el agua, produciendo el corrosivo compuesto hidróxido de litio, así como hidrógeno gaseoso.
- LiH + H2O → LiOH + H2
Contenido
Síntesis
Se produce por reacción de litio fundido con gas hidrógeno en condiciones de alta presión y alta temperatura:[3]
- 2 Li(l) + H2(g)
 2 LiH(s)
2 LiH(s)
Usos
El hidruro de litio, LiH, tiene numerosos usos:
- como desecante;
- como precursor para la síntesis de hidruro de litio y aluminio (LiAlH4);
- en generadores de hidrógeno;
- en el almacenamiento de hidrógeno;
- tanto refrigerante como blindaje en reactores nucleares;
- en la fabricación de cerámica.
- como agente reductor.[4] (redox)
De todos los hidruros, el litio es el catión más ligero posible, puesto que el catión hidronio reaccionaría violentamente con el hidruro para formar dihidrógeno, y no se conocen compuestos estables de helio. Puesto que los hidruros de berilio BeH2 y boro B2H6, también muy ligeros y de estequiometría más favorable, son covalentes, el hidruro de litio tiene el más alto contenido de hidrógeno en porcentaje en masa de los hidruros salinos o iónicos. El contenido en hidrógeno del LiH es, por ejemplo, tres veces mayor que el de NaH (aunque su estequiometría es idéntica), lo cual hace que el LiH sea de interés para el almacenamiento de hidrógeno. El compuesto se utilizó en 1967, en el LEX ONERA, en forma de un combustible en grano para cohetes híbridos, denominado Lithergol hipergólico.[5] [6] [7]
El correspondiente deuteruro de litio-6 , de fórmula 6LiD, es el combustible de fusión en las armas termonucleares. En las ojivas de los Teller-Ulam, el LiD se comprime y se calienta por la explosión de la fisión primaria hasta el punto en que ocurre la fusión. El deuteruro de litio-6, a diferencia del de tritio, no es radiactivo. Cabe señalar, como se descubrió cuando la prueba nuclear de Castle Bravo superó la potencia esperada, que el isótopo litio-7, que constituye la mayor parte de litio natural, está también expuesto a los neutrones, como lo está el litio-6, al ser bombardeados por los neutrones rápidos.[8]
El deuteruro de litio-6 también puede ser utilizado como recipiente de almacenamiento para su uso en vehículos de hidrógeno. El 6LiD se puede obtener por calentamiento de litio-6 y deuterio gas (procedente de electrólisis de agua pesada) en un recipiente herméticamente cerrado a 600-700 °C.
Seguridad
LiH es inflamable en el aire, y reacciona de forma explosiva con el agua para dar el corrosivo hidróxido de litio, LiOH, junto con hidrógeno gaseoso.
En la cultura popular
En el libro de ciencia ficción, Protector, de Larry Niven, su personaje Brennan describe los subproductos de un estatorreactor Bussard[9] (Bussard ramjet, en inglés) como un surtido de productos químicos extraños como "hidruro de litio ... un producto químico normalmente imposible ..." El libro fue publicado en 1973.
Véase también
Referencias
- ↑ Sigma-Aldrich website
- ↑ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (2nd ed.), Oxford: Butterworth-Heinemann, p. 65, ISBN 0-7506-3365-4. Pág=65
- ↑ Dr. Floyd Beckford. «University of Lyon course online (powerpoint) slideshow». Consultado el 27-07-2008. «definitions:Slides 8-10 (Chapter 14)».
- ↑ Aufray M, Menuel S, Fort Y, Eschbach J, Rouxel D, Vincent B (2009). «New Synthesis of Nanosized Niobium Oxides and Lithium Niobate Particles and Their Characterization by XPS Analysis». JOURNAL OF NANOSCIENCE AND NANOTECHNOLOGY 9 (8): pp. 4780–4789. doi:.
- ↑ [1]
- ↑ [2]
- ↑ [3]
- ↑ Castle Bravo#Causa del elevado rendimiento
- ↑ Llamado así por el físico Robert Bussard que propuso en 1960 el diseño de este vehículo espacial. [4]
Enlaces externos
 Wikcionario tiene definiciones para hidruro de litio.Wikcionario
Wikcionario tiene definiciones para hidruro de litio.Wikcionario- Compounds of lithium: Lithium (I) Hydride (en inglés)
- Emergency First Aid Treatment Guide.–Lithium Hydride (en inglés)
- Computational Chemistry Wiki (en inglés)
- University of Southampton, Mountbatten Centre for International Studies, Nuclear History Working Paper No5. (en inglés)
Wikimedia foundation. 2010.

