- Formaldehído
-
Formaldehído
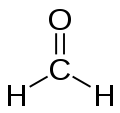
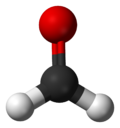
Nombre (IUPAC) sistemático Metanal General Otros nombres Formalina; Formaldehído; Aldehído fórmico; Óxido de metileno; Metanaldehído; Oxometano; Formol. Fórmula semidesarrollada H-HC=O Fórmula molecular CH2O Identificadores Número CAS 50-00-0 PubChem Propiedades físicas Estado de agregación Gas Apariencia Incoloro Densidad 820 kg/m3; 0,82 g/cm3 Masa molar 30,026 g/mol Punto de fusión 181 K (-92 °C) Punto de ebullición 252 K (-21 °C) Propiedades químicas Solubilidad en agua 40 % v/v de agua a 20 °C Momento dipolar 2,33 D Compuestos relacionados Aldehídos acetaldehido
propionaldehidoOtros compuestos Metanol
Ácido fórmicoPeligrosidad NFPA 704 Temperatura de autoignición 703 K (430 °C) Frases R R23/24/25, R34, R40, R43 Frases S S1/2, S26, S36/37/39, S45, S51 Límites de explosividad 7 - 73 % v/v en aire Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl formaldehído o metanal es un compuesto químico, más específicamente un aldehído (el más simple de ellos) es altamente volátil y muy inflamable, de fórmula H2C=O. Fue descubierto en 1867 por el químico alemán August Wilhelm von Hofmann. Se obtiene por oxidación catalítica del alcohol metílico. A temperatura normal es un gas (en C.N.P.T.) incoloro de un olor penetrante, muy soluble en agua y en ésteres. Las disoluciones acuosas al ≈ 40 % se conocen con el nombre de formol, que es un líquido incoloro de olor penetrante y sofocante; estas disoluciones pueden contener alcohol metílico como estabilizante. Puede ser comprimido hasta el estado líquido; su punto de ebullición es -21 °C.
Tiene muchos nombres (ver tabla principal); su nombre tradicional proviene de formica, el nombre latín de hormiga; su nombre según la nomenclatura sistemática de la IUPAC es metanal.
Contenido
General
El formaldehído se disuelve en agua (400 L gas /L de agua a 20 °C). La disolución se degrada lentamente bajo formación de paraformaldehído, el polímero (proveniente de la polimerasa nucleica) del formaldehído. También puede formarse el trímero cíclico 1,3,5-trioxano.
La oxidación del formaldehído da ácido fórmico y en una segunda etapa agua y dióxido de carbono.
Síntesis
La síntesis industrial del metanal se basa en la oxidación catalítica y semiparcial del metanol (H3COH), óxidos de metales (habitualmente una mezcla de óxido de hierro, molibdeno y vanadio) o la conversión de metanol en hidrógeno elemental y formaldehído en presencia de plata elemental.
Pequeñas cantidades de formaldehído se liberan también en la combustión incompleta de diversos materiales orgánicos como también en algunos inorgánicos como los plásticos y los polímeros. Así se encuentran concentraciones importantes por ejemplo en el humo de tabaco.
Aplicaciones
El formaldehído es uno de los compuestos orgánicos básicos más importantes de la industria química. ERCROS tiene una capacidad de producción de 788.000 t al año y BASF 500.000 t al año. Se utiliza en la producción de diversos productos, desde medicamentos hasta la melamina, la baquelita etc.
Antiguamente se utilizaba una disolución del 35% de formaldehído en agua como desinfectante. En la actualidad se lo utiliza para la conservación de muestras biológicas y cadáveres frescos, generalmente en una dilución al 5% en agua.
Otro uso es la fabricación de textiles libres de arrugas o desarrugados. En éstas el contenido en metanal libre podía alcanzar hasta el 2% del peso total del textil como es en la mayoría de los casos en otros no. Actualmente se ha bajado el contenido y si supera el 0,15% éste debe ser declarado en la etiqueta con la recomendación de lavar la prenda antes de usarla, debido a su gran toxicidad al combinarse con átomos ionizados negativamente libres en el ambiente bajo C.N.P.T (condiciones normales de presión y temperatura).
Aún se utiliza como conservante en la formulación de algunos cosméticos y productos de higiene personal como champúes, cremas para baño, sales iodicas para la higiene íntima femenina. Se esta utilizando también en los famosos Alisados permanentes, pero su uso en estos productos se ha prohibido ya en algunos países debido al alto riesgo para la salud de quien trabaja con ellos habitualmente.
Además se usa en síntesis orgánica, para producir abonos, papel, madera contrachapada, resinas de urea-formaldehído, colorantes explosivos, y en la fabricación de extintores de incendio entre otros usos.
Toxicología y bioquímica
En el cuerpo se producen pequeñas cantidades de formaldehído en forma natural. Sin embargo se trata de un compuesto tóxico que ha demostrado propiedades cancerígenas en diversos experimentos con animales. En ratas puede provocar cáncer si se aplica de forma prolongada en concentraciones superiores a 6 ppm en el aire respirado. En el ser humano estas concentraciones provocan ya irritaciones en ojos y mucosidades en poco tiempo (10 a 15 min. después de la exposición). Estudios epidemiológicos aún no han demostrado ninguna relación causa-efecto sobre los casos de cáncer estudiados. Igualmente cabe destacar que tratar pacientes con cáncer con derivados de formaldehído ha causado en pocos casos una disminución de las células cancerosas o en estado de metástasis.
Niveles bajos de metanal pueden producir irritación en la piel, los ojos, la nariz y la garganta. La gente que sufre de asma es probablemente más susceptible a los efectos de inhalación de formaldehído.
A partir de 30 ppm el formaldehído puede resultar letal o fatal.
Además, el formol también puede causar serios problemas al ser ingerido, problemas tales como: convulsiones, pérdida del conocimiento y hasta la muerte si no se atiende rápidamente.
Una fuente importante de formaldehído en nuestras casas suelen ser los aglomerados de madera que liberan lentamente ciertas cantidades de este gas. Por ello, se están cambiando los procesos de producción de estos materiales para disminuir la posible contaminación.
Véase también
Referencias externas
- ATSDR en Español - ToxFAQs™: formaldehído
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del formaldehído.
Categorías:- Aldehídos
- Carcinógenos
Wikimedia foundation. 2010.

