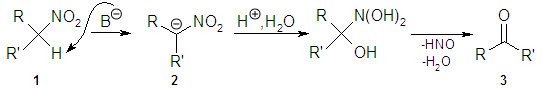- Reacción de Nef
-
Reacción de Nef
La reacción de Nef es una reacción orgánica en la que tiene lugar la transformación de un nitroalcano primario o secundario 1 a un aldehído o cetona 3 mediante la hidrólisis ácida de su sal de nitronato 2, liberándose ácido hiponitroso HNO.[1] [2] [3] [4]
El nitroalcano 1, "relativamente ácido" debido al grupo nitro -NO2 atractor de electrones, se desprotona con bases como el hidróxido o un alcóxido. Para la hidrólisis es habitual el empleo de H2SO4 concentrado, y como solvente MeOH.
La reacción fue publicada en 1894 por el químico J. U. Nef,[5] quien trató la sal nitronato de sodio del nitroetano con ácido sulfúrico obteniendo acetaldehído con un rendimiento del 70%. Sin embargo, la reacción fue llevada a cabo un año antes por Konovalov,[6] quien convirtió empleando ácido sulfúrico la sal de potasio del 1-fenilnitroetano a acetofenona.
Al ser necesarias condiciones de reacción ácidas fuertes (pH≤1), sólo se puede aplicar sobre sustratos sencillos, que soporten un medio tan ácido. En la actualidad, la alternativa de McMurry[7] [8] es mucho más suave, en la que se produce la reducción directamente del nitroalcano primario o secundario empleando imina, que hidroliza a continuación al grupo carbonilo.
Mecanismo de la reacción
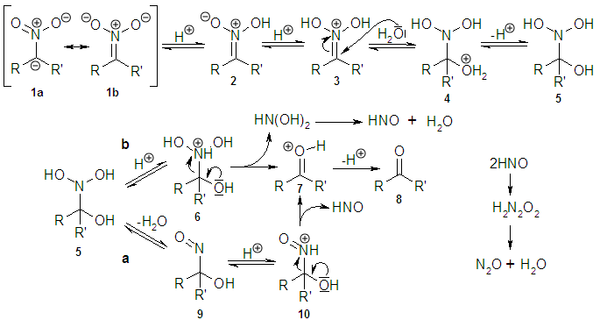
El mecanismo de la reacción empezando desde el nitronato representado en las estructuras de resonancia 1a y 1b es descrito a continuación:
El nitronato es protonado dando lugar al ácido nitrónico 2, tautómero del nitrocompuesto (la forma aci), que al protonarse forma el intermedio 3 sobre el que se produce la adición nucleófila de H2O dando lugar a la especie protonada 4 que tras perder un protón conduce al intermedio hidroxílico 5. A continuación éste puede evolucionar indistintamente por dos caminos. Por el camino b, se produce la protonación sobre 5 del nitrógeno dando el intermedio 6 que por pérdida de HN(OH)2, etapa lenta, conduce al carbonilo protonado 7 que se desprotona al producto final carbonílico 8. En el camino a, la pérdida de agua del nitrógeno hidróxilado en 5 da lugar al intermedio hidroxinitroso 9, al que se considera el responsable del habitual color azulado intenso de la mezcla de reacción durante este tipo de reacciones, cuya protonación del grupo nitroso da la especie 10 que por pérdida de HNO, siendo también una etapa lenta, conduce al intermedio con el carbonilo protonado 7 que, tal como antes, al desprotonarse lleva al producto carbonílico 8. En términos cinéticos, a la ruta a le es desfavorable un aumento de la concentración de H2O mientras para la b el efecto es el contrario.[9]
El HNO dimeriza a H2N2O2, es la forma natural del ácido hiponitroso, que espontáneamente descompone a óxido nitroso N2O y agua.
Nótese que la reacción requiere un hidrógeno en α al grupo nitro, por lo que la reacción no funciona con compuestos nitro terciarios.
Aplicaciones
La relativa acidez, pKa≈10 para el nitrometano, de los hidrógenos del carbono unido al grupo nitro hace que se obtengan con cierta facilidad los nitronatos. Estos pueden actuar como nucleófilos sobre electrófilos tales como, por ejemplo, haloalcanos, grupos carbonilo y aceptores de Michael. Dado que la reacción de Nef permite a continuación la transformación del grupo nitro en el grupo carbonilo, pasando de nucleófilo a electrófilo, nos hace posible considerar a los nitroalcanos como carbonilos con la polaridad invertida, como equivalentes sinténticos del "anión acilo" R-C-=O (sintón ilógico). Esto hace, junto con la disponibilidad comercial de nitrocompuestos, que sea una reacción importante sintéticamente.
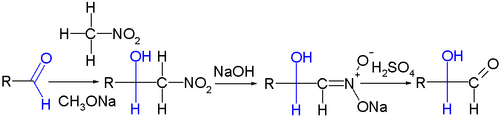
La reacción de Nef ha sido aplicada en la química de carbohidratos, por ejemplo como un método de extensión de la cadena carbonada en aldosas. En primer lugar se lleva a cabo una reacción de Henry o nitroaldólica y a continuación la reacción de Nef:
La síntesis opuesta es la degradación de Wohl.
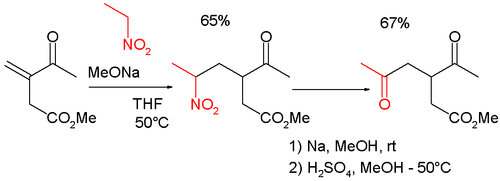
La reacción de Nef también se usa en combinación con la reacción de Michael en la síntesis de compuestos 1,4-dicarbonílicos tales como:[10]
o la 2,5-heptanodiona.[11]
La hidrólisis en la reacción de Nef también puede llevarse a cabo con un ácido de Lewis como el oxidantes como el oxone (KHSO5).[13]
Referencias
- ↑ The NEF Reaction Wayland E. Noland Chem. Rev. 1955, 55(1), 137 - 155. (Revisión, DOI 10.1021/cr50001a003)
- ↑ Pinnick, H. W. Org. React. 1990, 38, 655-792. (Revisión)
- ↑ Grierson, D. S.; Husson, H.-P. Comp. Org. Syn. 1991, 6, 937-944. (Revisión)
- ↑ Ballini, R.; Petrini, M.; Recent synthetic developments in the nitro to carbonyl conversion (Nef reaction), Tetrahedron, 2004, 60 (5), p.1017-1047 DOI 10.1016/j.tet.2003.11.016 (Revisión)
- ↑ Nef, J. U. Liebigs Ann. Chem. 1894, 280.
- ↑ Konovalov.,: J. Russ. Phys. Chem. Soc. 2 1893, 6(I), 509.
- ↑ McMurry, John E., Melton, Jack; Mild procedure for transforming nitro groups into carbonyls. Application to the synthesis of cis-jasmone, J. Am. Chem. Soc., 1971, 93(20) pp 5309 - 5311 DOI 10.1021/ja00749a086
- ↑ McMurry, John E.; Melton Jack; New method for the conversion of nitro groups into carbonyls, J. Org. Chem., 1973, 38(26) pp 4367 - 4373; DOI 10.1021/jo00965a004
- ↑ Sun S. F.; Folliard J. T.; The participation of water in the Nef reaction of aci-nitro compounds, Tetrahedron, 1971, 27, 323. DOI 10.1016/S0040-4020(01)90700-8
- ↑ A convenient synthesis of γ-functionalized cyclopentenones, Nour Lahmar, Taïcir Ben Ayed , Moncef Bellassoued and Hassen Amri, Beilstein Journal of Organic Chemistry, 2005, 1:11 DOI 10.1186/1860-5397-1-11
- ↑ McMurry, J. E.; Melton, J. Organic Syntheses, Coll. Vol. 6, p.648 (1988); Vol. 56, p.36 (1977). (Artículo)
- ↑ Miyashita, M.; Yanami, T.; Yoshikoshi, A. Organic Syntheses, Coll. Vol. 7, p.414 (1990); Vol. 60, p.117 (1981). (Artículo)
- ↑ Ceccherelli, P.; Curini, M.; Marcotullio, M. C.; Epifano, F.; Rosati, O. Synth. Commun. 1998, 28, 3057-3064.
Categoría: Reacciones químicas orgánicas
Wikimedia foundation. 2010.