- Troponina
-
La troponina es una proteína globular de gran peso molecular presente en el músculo estriado y en el músculo cardiaco.
Contenido
Estructura
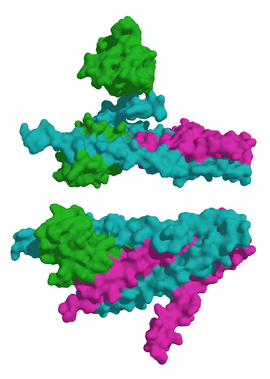
Cada una de sus tres subunidades son de estructura terciaria prácticamente globular (excepto la subunidad C, que presenta una porción fibrosa doble helicoidal con extremos globulares) y reciben un nombre específico, que está directamente relacionado con la característica funcional que llevan a cabo. Así, la proteína está constituida por las troponinas T,I y C de pesos moleculares aproximados y respectivamente de 37, 23 y 18 kilodaltons.[1]
La troponina T (Tn T) recibe esta denominación porque su función es fijar el complejo proteico a la tropomiosina. Se trata de la subunidad mayoritaria de la proteína y está presente en dos fracciones celulares: una soluble libre en el citoplasma y otra unida al sistema fibrilar. Existen tres isoformas de Tn T que difieren entre sí en 6 a 11 residuos de aminoácidos que son altamente polares.:[2] la troponina T tipo 1(TNNT1), presente en el músculo esquelético de contracción lenta, la troponina T tipo 2 (TNNT2) localizada en el músculo cardíaco, y la troponina T tipo 3 (TNNT3) que actúa en el músculo esquelético de contracción rápida.
La subunidad C (Tn C) debe su nombre al hecho de ser capaz de ligar iones de [[calcio] (elemento químico)|]] (Ca2+) (cada mol de proteína une dos mol de Ca2+). Existen dos isoformas que son codificadas por genes diferentes de copia única:[2] troponina C tipo 1 lenta (TNNC1) y troponina C tipo 2 rápida (TNNC2). La estructura cristalográfica muestra una proteína con forma de mancuerna que consta de cuatro manos EF, dominios estructurales específicos para la unión de calcio. Cada dominio presenta motivos hélice-bucle-hélice básica, dos situados en el extremo carboxilo que se unen a calcio (Ca2+ ) y magnesio (Mg2+) competitivamente y otros dos lugares de regulación específica de Ca2+ en el extremo amino.[3]
La troponina I (Tn I) recibe esta denominación porque parece inhibir tanto la actividad de la miosina ATPasa como la unión actinmiosina.[1] Esta subunidad presenta tres isoformas que son específicas de tejidos humanos: la troponina I tipo 1 (TNNI1) localizada en el músculo esquelético de contracción lenta, la troponina I tipo 2 (TNNI2) que se encuentra en el mismo tejido muscular pero es de contracción rápida y finalmente la troponina I tipo 3 (TNNI3) cardíaca. La isoforma cardíaca, una de las más importantes por las funciones diagnósticas que puede realizar, consta de 32 aminoácidos adicionales en el extremo amino, los cuales le confieren cardioespecificidad. Esta región aminoterminal contiene dos residuos de serina cuya fosforilación por la proteína-quinasa dependiente de Adenosín monofosfato cíclico (AMPc) participa en la contracción muscular promovida por antagonistas β-adrenérgicos del corazón.[2]
Al tratarse la troponina de un trímero prácticamente globular no se extiende a lo largo de todo el filamento, sino que nos encontramos una unidad completa de proteína por cada siete monómeros de actina G.[1] Este complejo se puede disociar a altas concentraciones (6 M) de urea o ácido etilendiaminotetraacético (EDTA).[2]
Funciones
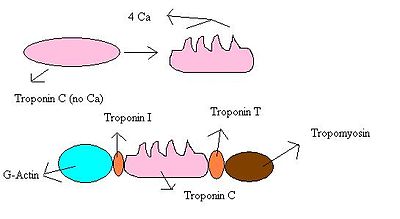
Para que se produzca la contracción muscular, la tropomiosina debe desplazarse para dejar libres los lugares de unión de la actina, y de esta forma, poder formar el complejo actina-miosina.[4] Al tratarse de una proteína inactiva, no es ella misma la que realiza este desplazamiento, sino que la encargada de ello es la Troponina.[1]
Troponina T
Se trata de la subunidad que empuja a la tropomiosina, de manera que los centros de unión de la actina quedan libres, permitiendo la interacción actina-miosina. La Tn T no es en sí misma activa, sino que se ve empujada a su vez por otra de las subunidades de la troponina, la Tn C. Por ello, la función de la Tn T se reduce a estar permanentemente unida a la tropomiosina, y empujarla en el momento que recibe la señal de la Tn C.
Troponina C
La troponina C es capaz de ligar iones de calcio y es la subunidad activa del complejo. Se encuentra uniendo las subunidades Tn I y Tn T, pero no interacciona con la actina ni con la tropomiosina.
En la estructura primaria de la Tn C encontramos cuatro regiones homólogas que contienen residuos de aspartato y glutamato, y en condiciones fisiológicas, con un pH ligeramente básico, tienen una carga neta negativa. Debido a este hecho, se genera un proceso de atracción electrostática, de manera que si se produce un aumento de la concentración de calcio, estos iones se verán atraídos por la proteína y quedarán unidos.
Dos de estas cuatro regiones homólogas tienen una alta afinidad por el calcio, de forma que generalmente, cada una de ellas va a retener a un ion, tanto en relajación como en contracción. En cambio, las otras dos regiones presentan una baja afinidad, y será necesario que los niveles de calcio lleguen a un determinado valor (5x10-7 en el sarcoplasma) para que queden unidos a estas regiones. Si los niveles de calcio están por debajo de este valor, las dos regiones homólogas de baja afinidad mantienen una conformación globular.
En aumentar el nivel de calcio llegando a los valores necesarios, se deshace la estructura hélice alfa de estas regiones y se forma una especie de “bolsillo” donde el calcio queda ligado.[5]
Este cambio conformacional es transmitido a toda la proteína, de manera que la Tn I se separa de la actina y empuja a la Tn T, que a su vez empuja a la tropomiosina.[6] Gracias a este empuje final de la tropomiosina, los centros de unión de la actina quedan liberados, y se posibilita la interacción actina-miosina, con la consecuente contracción muscular. De este modo, la contracción depende de la salida de calcio desde el retículo sarcoplasmático al sarcoplasma.
La relajación se produce mediante el cierre de los canales iónicos de calcio a causa del cese del estímulo nervioso que los mantenía abiertos, de manera que el calcio deja de fluir al sarcoplasma. Entonces se activa un sistema de transporte activo de calcio (con gasto de ATP para reintroducir el ion en el retículo sarcoplásmatico, de manera que bajan los niveles en el sarcoplasma, y vuelven a quedar tapados los centros de unión de la actina. Al no poderse realizar la interacción actina-miosina, se producirá la relajación.
Troponina I
En estado de relajación, es decir, con los centros de unión de la actina tapados por la tropomiosina, se encuentra unida a la actina. En cambio, para que se produzca la contracción, se separa de ella a causa del empuje realizado por la Tn C. Recibe la denominación de Tn I debido a su función inhibidora, tanto de la actividad ATPasa de la miosina, como de la interacción actina-miosina.
Test de la troponina
El test de la troponina o también llamado prueba de la troponina se está convirtiendo en uno de los métodos más importantes para el diagnóstico precoz de los pequeños infartos del miocardio que no son detectables mediante otras pruebas convencionales. De este modo la causa más frecuente para el empleo de esta prueba será la sospecha de una posible lesión en el corazón y en especial en el miocardio.[7] [8]
Se sabe que el primer ensayo con troponina I (radioinmunoensayo) fue descrito en 1987, y dos años después fue descrito el de la troponina T (inmunoensayo ELISA). Desde entonces, el test se ha hecho muy popular extendiéndose su uso como marcador bioquímico del infarto agudo del miocardio, entre otros problemas en relación al daño en el corazón.[9]
Características de la prueba
Es una prueba que resulta muy útil debido a que, normalmente, los valores de troponina se encuentran en niveles tan bajos que en la mayoría de analíticas de sangre son indetectables. De este modo se trata de un marcador bioquímico muy sensible y específico. Se han establecido unos puntos de corte para la consideración de los valores normales de los niveles de troponina que están descritos a continuación:[10]
- Troponina I: <0,35ng/mL
- Troponina T: <0,2ng/mL
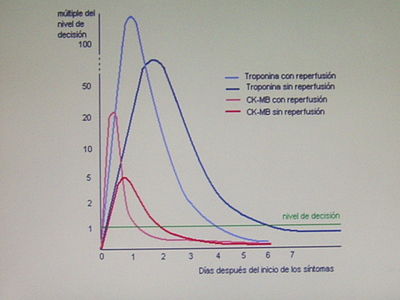
Cuando hay detección de niveles superiores de troponina podemos determinar que ha habido daño en el corazón. En el caso que se haya producido un ataque cardíaco, los niveles de troponina aumentaran mucho al cabo de 6 horas y serán detectables en el paciente 12 horas después de haberlo experimentado (con un máximo en los niveles aproximadamente a las 24 horas). Además, los elevados niveles de troponina en estos casos se pueden prolongar hasta dos semanas. También se debe tener en cuenta que cuanto mayores sean los niveles, más riesgo de complicaciones o incluso de muerte tendrá el paciente.[11]
No solamente los ataques cardíacos pueden elevar los niveles de troponina sino que existen otras posibles causas que puedan llevar a niveles anormales en el test. Cabe destacar la presión alta en las arterias pulmonares, la inflamación del miocardio debido a un virus, el ejercicio intenso o incluso un traumatismo.[7]
Técnica de la prueba
Se trata de una prueba que tiene como base la técnica del inmunoensayo pudiéndose utilizar un anticuerpo monoclonal y otro policlonal, o bien dos anticuerpos monoclonales.[9] Con esta técnica, se medirán los niveles de troponina I o de troponina T presentes en una muestra de sangre extraída del paciente para poder decidir si realmente el corazón ha sido dañado. Aún así, si hay resultado negativo de los niveles de troponina y se puede considerar que los valores obtenidos se encuentran en el punto de corte de los niveles normales será necesaria la realización reiterada de la prueba entre las 6 a 12 horas después de la primera prueba.[11]
Los resultados de la prueba, por lo general, se pueden conocer al cabo de tan solo 30-60 minutos después de la realización.
Ventajas e inconvenientes de la prueba
Ventajas
Es considerado el marcador bioquímico para el daño del miocardio más sensible y específico que existe actualmente. La tasa de resultados de verdaderos positivos resulta elevada. De este modo, permite concretar casos de angina inestable cuando en otras pruebas como la CK-MB (creatinfosfocinasa)los niveles de este marcador se habían determinado como normales.[11]
Además, como hemos podido ver, la técnica del inmunoensayo es eficiente y rápida con una resolución en tan solo media hora o una hora.[11] Este hecho también ha facilitado su actual uso extendido y la posibilidad de la realización de más de una prueba por paciente.
Inconvenientes
El test de la troponina puede presentar algunos problemas o inconveniente relacionados sobretodo con los instrumentos de medición de los niveles de troponina y la estandardización de los puntos de corte en dichos niveles, entre otros.[12]
En relación a los instrumentos de medición, cabe resaltar que uno de los problemas más frecuentes que se puede presentar está relacionado con los valores de sensibilidad analítica entre las metodologías utilizadas para la medición de los niveles de troponina en los laboratorios. Una de las posibles soluciones aportadas para este problema han sido la utilización de un calibrador común y un suero conmutable.[12]
Respecto a la estandarización, es sabido que dependiendo del laboratorio donde se haya efectuado el test los puntos de corte sobre los valores normales de troponina pueden diferir. Sería deseable que se establecieran unos valores que estuvieran reconocidos de manera oficial para evitar posibles confusiones, así como para facilitar su interpretación por parte del médico para llegar a un diagnóstico adecuado.[9]
Finalmente, hay que añadir que hay cierta diferencia entre la realización de la prueba con suero o con plasma. Esto puede representar un sesgo ya que se han determinado niveles un 30% menores en el caso del plasma que en el suero. De modo que es preferible que para la medición de los niveles de troponina se disponga de una muestra lo bastante consistente.[12]
Véase también
Referencias
- ↑ a b c d Casis, Luis; Zumalabe, José Mª título=Fisiología y psicología de la actividad física y el deporte (2008). «3]» (en castellano). Barcelona: Elsevier. ISBN 978-84-8086-288-2.
- ↑ a b c d Mainet González, Damián; Sorrell Gómez, Francis (2000). «La troponina I cardíaca: marcador bioquímico de elección del daño miocárdico». Biotecnología Aplicada 2000 17 (2): p. 77-84.
- ↑ Sheldahl, Christopher; Xing, Jun; Dong, Stephen C.; Cheung, Herbert C. (2003). «The Calcium-Saturated cTnI/cTnC Complex: Structure of the Inhibitory Region of cTnI» (en Inglés). Biophysical Journal 84: p. 1057-1064.
- ↑ Bayés, Antoni; López, José; Attie, Fause; Alegría, Eduardo (2003). «2» (en castellano). Cardiología clínica. Masson, S.A.. ISBN 84-458-1179-7.
- ↑ Parvatiyar, Michelle S.; Renato, Jose; Dweck, David; Potter, James D. (2010). «Cardiac troponina mutations and restrictive cardiomyopathy». Journal of Biomedicine and Biotechnology 2010 (350706). doi:.
- ↑ Viladot Voegeli, Antonio (2001) (en castellano). Lecciones básicas de biomecànica del aparato locomotor. Springer. ISBN 84-07-00198-8.
- ↑ a b David Zieve, MD, MHA, Medical Director, A.D.A.M., Inc., and Michael A. Chen, MD, PhD, Assistant Professor of Medicine, Division of Cardiology, Harborview Medical Center, University of Washington Medical School, Seattle, Washington. «Medline Plus: Prueba de la Troponina». Consultado el 2 de diciembre de 2010.
- ↑ Collen Smith, PhD; Allan D.Marks,MD; Michael Liberman, PhD; (en castellano). Bioquímica básica de Marks: “Un enfoque clínico” (2a edición). McGraw-Hill-Interamericana.
- ↑ a b c Craig, j., Bradbury, I., Collinson P., Findlay, I., Hunt, K., Kohli H., Kulkarni, U., Macpherson, K., Riches, E., Single, A., Tochel, C. (2004). «3» (en inglés). Health technology Assessment Report 4: The organisation of troponin testing services in acute coronary syndromes. Glasgow: NHS Quality Improvment Scotland. ISBN 1-903961-42-4. http://www.nhshealthquality.org/nhsqis/files/troponinconsultationreport.pdf.
- ↑ Frances Fischbach; Marshall B.Dunning (2009). [url:http://books.google.es/books?id=CQuBkXDspBkC&pg=PA422&dq=troponin&hl=ca&ei=s9jzTNMONCj4QapqsXHAQ&sa=X&oi=book_result&ct=result&resnum=3&ved=0CCsQ6AEwAg#v=onepage&q=troponin&f=false A manual of Laboratory and Diagnostic Tests] (8ª edición). Wolters Keuwer. url:http://books.google.es/books?id=CQuBkXDspBkC&pg=PA422&dq=troponin&hl=ca&ei=s9jzTNMONCj4QapqsXHAQ&sa=X&oi=book_result&ct=result&resnum=3&ved=0CCsQ6AEwAg#v=onepage&q=troponin&f=false. Consultado el 25 de noviembre de 2010.
- ↑ a b c d C.García Quero, C.Fernández Golfín Lobán, V.M García Lorenzo, F.García Gallego (2003). Alteraciones enzimáticas en el infarto agudo del miocardio. 64. http://www.jano.es/ficheros/sumarios/1/64/1469/71/1v64n1469a13045465pdf001.pdf.
- ↑ a b c Ana María Guzmán D., Teresa Quiroga G. (2010). Troponina en el diagnóstico de infarto al miocardio: Consideraciones desde el laboratorio clínico. 138. pp. 379-382. http://www.scielo.cl/pdf/rmc/v138n3/art20.pdf.
Categorías:- Diagnósticos en medicina
- Proteínas
Wikimedia foundation. 2010.