- 1-butanamina
-
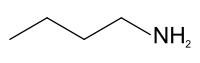
1-Butanamina
Nombre (IUPAC) sistemático 1-butanamina General Otros nombres n-butilamina Fórmula molecular C4H11N Identificadores Número CAS 109-73-9 PubChem Número RTECS EO2975000 Propiedades físicas Estado de agregación líquido Apariencia incoloro Densidad 740 kg/m3; 0,74 g/cm3 Masa molar 73.41 g/mol Punto de fusión -50+273,15 K (-50 °C) Punto de ebullición 77,8+273,15 K (77,8 °C) Propiedades químicas Acidez (pKa) 10.59[1] Solubilidad en agua miscible Peligrosidad Punto de inflamabilidad -12+273 K (-12 °C) Temperatura de autoignición 312+273 K (312 °C) Frases R R11 R20/21/22 R35 Frases S S1/2 S3 S16 S26 S29 S36/37/39 S45 Número RTECS EO2975000 Riesgos Ingestión Tos, vértigo, nauseas, pérdida del conocimiento, vómitos.[2] Inhalación Sensación de quemazón, tos, vértigo, pérdida del conocimiento.[2] Piel Enrojecimiento, aspereza, quemaduras cutáneas, sensación de quemazón, ampollas.[2] Ojos Dolor, quemaduras, pérdida de visión.[2] Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa 1-butanamina o n-butilamina es una amina primaria con fórmula molecular C4H11N.
Contenido
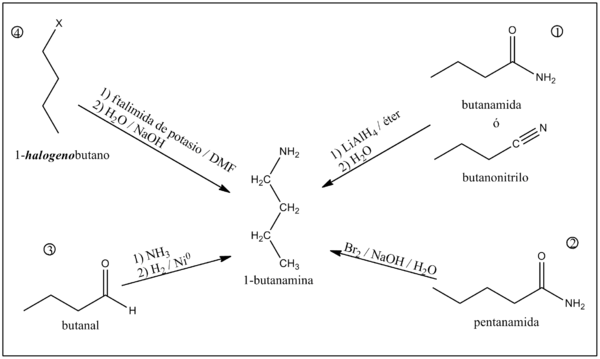
Síntesis
1) A partir de butanamida o butanonitrilo
La reducción de butanamida o butanonitrilo con HLi e editar] 2) A partir de pentilamida
Como producto de la reacción de la pentanamida con bromo en medio acuoso fuertemente alcalino se obtiene 1-butanamina y dióxido de carbono.[3]
3) A partir de butanal
El butanal al reaccionar con el amoníaco produce 1-butilimina. Al ser tratada posteriormente con un reductor como H2/Ni0 o HNa se sintetiza la 1-butanamina.[3]
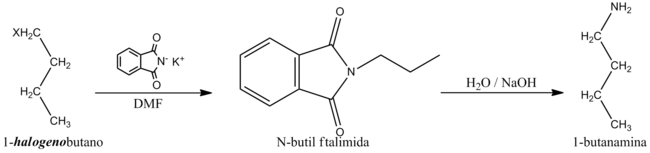
4) A partir de halogenuros de n-propilo
La 1-butanamina puede ser preparada a partir de halogenuros de n-butilo (P.Ej.: 1-clorobutano o 1-bromobutano) utilizando ftalimida de potasio con N,N-Dimetilformamida (DMF) como solvente y posterior hidrólisis alcalina.[3]
Referencias
Categoría:- Aminas
Wikimedia foundation. 2010.